微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列判断正确的是[???? ]
A.0.1mol/L的盐酸和0.1mol/L的醋酸分别与2mol/L的NaOH反应的速率相同
B.0.1mol/L的盐酸和0.1mol/L的硝酸分别与大小相同的大理石反应的速率相同
C.Mg和Fe分别与0.1mol/L的盐酸反应的速率相同
D.大理石块与大理石粉分别与0.1mol/L的盐酸反应的速率相同
参考答案:B
本题解析:
本题难度:简单
2、选择题 某学生用纯净的Cu与过量浓HNO3反应制取NO2,实验结果如图所示,对图中曲线的描述正确的是
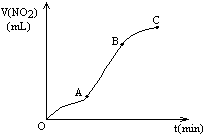 [???? ]
[???? ]
A.A段表示开始时,反应速率稍慢
B.B段表示反应速率较快,可能因为产物有催化作用
C.BC段表示反应速率最快,在该时间内收集到的气体最多
D.可在BC段收集纯净的气体
参考答案:AB
本题解析:
本题难度:一般
3、选择题 工业上制备纯硅反应的化学方程式为SiCl4(g) + 2H2(g)  Si(s) + 4HCl(g) △H>0,下列措施能提高反应速率且使平衡向正反应方向移动的是
Si(s) + 4HCl(g) △H>0,下列措施能提高反应速率且使平衡向正反应方向移动的是
A.升温
B.加压
C.减压
D.加催化剂
参考答案:A
本题解析:反应是体积增大的、吸热的可逆反应。所以升高温度,反应速率加快且平衡向正反应方向移动。加压反应速率加快,但平衡向逆反应方向移动。减压反应速率降低,平衡向正反应方向移动。催化剂可以改变反应速率,但不能影响平衡状态。所以正确的答案是A。
本题难度:一般
4、实验题 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
编号
| 操作
| 实验现象
|
①
| 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。
| 试管A中不再产生气泡;
试管B中产生的气泡量增大。
|
②
| 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液
| 试管A、B中均未明显见到有气泡产生。
?
(1)过氧化氢分解的化学方程式为__________________________________________。
(2)实验①的目的是______________________________________________________。实验中滴加FeCl3溶液的目的是_________________________________________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是__________________________________(用实验中所提供的几种试剂)。
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最慢的是______________________。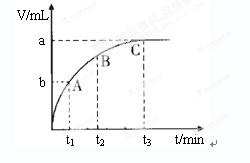
参考答案:(10分)(1)2H2O2 本题解析: 本题解析:
试题分析:(1)过氧化氢不稳定,容易分解生成水和氧气,则2H2O2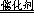 2H2O+O2↑;(2)实验①中过氧化氢的浓度和体积相同,氯化铁溶液的浓度和体积也相同,只有反应温度不同,分别是5℃、40℃,根据控制变量设计实验探究的规律,实验①的目的是研究温度对H2O2分解速率的影响;氯化铁溶液是双氧水分解反应的催化 2H2O+O2↑;(2)实验①中过氧化氢的浓度和体积相同,氯化铁溶液的浓度和体积也相同,只有反应温度不同,分别是5℃、40℃,根据控制变量设计实验探究的规律,实验①的目的是研究温度对H2O2分解速率的影响;氯化铁溶液是双氧水分解反应的催化
本题难度:一般
5、选择题 NO和NO2都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮和二氧化碳气,2NO+2CO=N2+2CO2,对此反应,下列叙述正确的是(双选)……( )
A.使用催化剂能加快反应速率
B.改变压强对反应速率没有影响
C.冬天气温低,对人危害更大
D.外界任何条件怎样改变,均对此化学反应速率无影响
参考答案:AC
本题解析:这是一个气体物质间的化学反应,改变反应物的浓度、压强、温度均能改变该反应的速率。所以D错误。
增大压强,可以使气体物质的体积变小,其浓度变大,所以反应速率加快,反之,减小压强,可使气体的体积变大,浓度变小,反应速率变慢,由于该反应是气体物之间的反应,改变压强,对反应速率有影响,故B也错误。
升高温度,可以加快反应速率,降低温度可减慢反应速率。由于NO和CO对人的危害远大于N2和CO2,所以当NO与CO反应生成N2和CO2的速率降低时,对人危害更大。故C正确。
催化剂可以改变化学反应
本题难度:一般
|