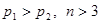微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于可逆反应2HI(g)  I2(g)+H2(g),下列叙述能够说明已达到平衡状态的是
I2(g)+H2(g),下列叙述能够说明已达到平衡状态的是
A.各物质的量的浓度比2 : 1 : 1
B.容器内的总压不随时间变化
C.断裂2 mol H-I键的同时生成1 mol I-I键
D.混合气体的颜色不再变化时
2、实验题 工业废水中常含有一定量的 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为????????????????????????????????????

其中第①步存在平衡:?????????????

(1)若平衡体系的pH=2,则溶液显???????????色.
(2)能说明第①步反应达平衡状态的是????????????。
a.Cr O
O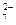
 和CrO
和CrO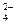 的浓度相同
的浓度相同
b.2v (Cr O
O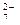 ) ="v" (CrO
) ="v" (CrO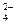 )
)
c.溶液的颜色不变
(3)第②步中,还原1mol Cr O
O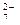 离子,需要???????mol的FeSO
离子,需要???????mol的FeSO ·7H
·7H O。
O。
(4)第③步生成的Cr(OH) 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡:
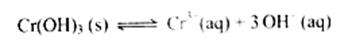
常温下,Cr(OH) 的溶度积
的溶度积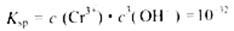 ,要使c(Cr3+)降至10
,要使c(Cr3+)降至10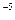 mol/L,溶液的pH应调至?????????。
mol/L,溶液的pH应调至?????????。
方法2:电解法
该法用Fe做电极电解含Cr O
O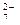 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH) 沉淀。
沉淀。
(5)用Fe做电极的原因为??????????????????????????????????????????????????????。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)??????????????????????????????。
溶液中同时生成的沉淀还有????????????????????。
3、填空题 恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2 (g) + 3 H2(g) 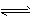 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值__________;
(2)反应达平衡时,混合气体的体积为726.8L(标况下),其中NH3的含量(体积分数)为25%。 计算平移时NH3的物质的量_________。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) =________ 。
(4)原混合气体中,a∶b = ___________。
(5)达到平衡时,N2和H2的转化率之比,(N2)∶ (H2)= ___________。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =_________________ 。
4、选择题 FeCl3溶液与KSCN溶液混合,发生反应:Fe3+(aq)+SCN-(aq) [Fe(SCN)]2+(aq) △H。其中[Fe(SCN)]2+的浓度与温度T的关系如图所示。下列说法正确的是
[Fe(SCN)]2+(aq) △H。其中[Fe(SCN)]2+的浓度与温度T的关系如图所示。下列说法正确的是

A.△H>O
B.反应处于D点时,一定有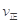 >
>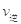
C.溶液中c(Fe3+):A点>B点
D.T1、T2时相应的平衡常数分别为K1、K2,则K1<K2
5、选择题 下图为可逆反应

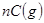 (正反应放热)生成物C的浓度随压强变化并建立平衡的关系图,则
(正反应放热)生成物C的浓度随压强变化并建立平衡的关系图,则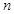 值与压强
值与压强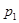 、
、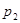 的关系正确的是
的关系正确的是

A.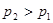 ,
,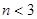
B.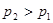 ,
,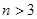
C.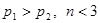
D.