微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知某管道煤气的主要成分是H2和CO,天然气的主要成分是CH4,它们燃烧的热化学方程式为
2H2(g)+O2(g)=2H2O(l) △H=-571. 6kJ/mol
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890. 31kJ/mol
当使用管道煤气的用户改用天然气后,在相同条件下燃烧等体积的可燃气体,理论上所获得的热量,后者大约是前者的多少倍
[???? ]
A.0.8
B.1.3
C.1.6
D.3.1
2、选择题 相同状况下:H2(g)+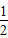 O2(g)=H2O(g);△H=-Q1?kJ/mol;2H2(g)+O2(g)=2H2O(l);△H=-Q2?kJ/mol
O2(g)=H2O(g);△H=-Q1?kJ/mol;2H2(g)+O2(g)=2H2O(l);△H=-Q2?kJ/mol
则Q1和Q2的关系为( )
A.Q1>Q2
B.Q1=Q2
C.2Q1<Q2
D.Q1=1/2Q2
3、简答题 能源是影响全球经济和生活的首要因素.已知下列热化学方程式:
①H2(g)+
1
2
O2(g)═H2O(l)△H=-285kJ/mol
②H2O(g)═H2(g)+1
2
O2(g)△H=+241.8kJ/mol
③C(s)+1
2
O2(g)═CO(g)△H=-110.4kJ/mol
④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
如果完全燃烧2gH2生成液态水,那么放出的热量为______kJ.
4、选择题 在下列四种溶液中,分别加入少量固体二氧化锰,能产生气体的是
A.3%H2O2溶液
B.1 mol·L-1NaOH溶液
C.1 mol·L-1KClO3溶液
D.1 mol·L-1盐酸
5、填空题 2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的
ΔH=-99kJ·mol-1。请回答下列问题
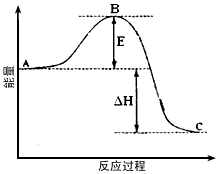
(1)图中A、C分别表示___________、___________,E的大小对该反应的反应热有无影响?______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?___________,理由是______________________;
(2)图中△H=___________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式______________________;
(4)如果反应速率v(SO2)为0.05 mol·L-1·min-1,则v(O2)=___________mol·L-1·min-1、
v(SO3)=___________mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3molSO3(g)的△H (要求计算过程)。
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772