微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 关于1 mol·L-1的硫酸溶液的下列叙述,不正确的是()
A.1 L该溶液中含溶质98 g
B.从10 mL该溶液中取出5 mL后,剩余溶液浓度仍为1 mol·L-1
C.将4.9 g浓硫酸加入盛有50 mL蒸馏水的烧杯中,充分混合就可配得该浓度的硫酸溶液
D.该浓度的硫酸具有酸的通性,但不具有强氧化性
参考答案:C
本题解析:配制1 mol·L-1的硫酸应取含4.9 g纯硫酸的浓硫酸稀释成50 mL溶液。
本题难度:简单
2、实验题 [2012·广东肇庆市一模](14分)I:某兴趣小组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如下图实验装置。请回答:

(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为????????;
C中反应的离子方程式为?????????????????????????????。
(2)为了实现绿色环保的目标,某同学设计了上图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是????????????????????????????????????(写两点)。
II:用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。请回答:
(3)氨水吸收过量SO2的反应的离子方程式为?????????????????????????????。
(4)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
实验操作
| 预期现象与结论
|
步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量。
| 若出现白色浑浊,则溶液中存在SO32-或 SO42-。
|
步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体?????????????????????????
???????????????????????????????????????????。
| ??????????????????????????
?????????????????????。
|
步骤3:???????????????????????????????????????????????
????????????????????????????????????????????。
| ??????????????????????????
??????????????????????。
参考答案:(14分)(1)品红溶液??? SO2+I2+2H2O =S
本题解析:(1)用碘水检验SO2的还原性,该反应的离子方程式为:SO2+I2+2H2O =SO42-+2 I-+4H+,用H2S检验SO2的氧化性,该反应的反应方程式为:2H2S+SO2=3S↓+2H2O,用品红溶液检验SO2的漂白性,故B中所盛试剂为品红溶液。
(2)用装置A2制取SO2的优点有:①反应不需要加热,比较安全;②用分液漏斗滴加反应物浓硫酸,易于控制反应进行;③滴加的浓硫酸能够与Na2SO3充分反应。
(3)过量的SO2与氨水反应生成亚硫酸氢铵,反应的离子方程式为:NH3·H2O+SO2=
本题难度:一般
3、选择题 向盐酸中加入浓H2SO4时,会有白雾生成。下列叙述不属于导致产生该现象的原因的是…( )
A.浓H2SO4具有脱水性
B.浓H2SO4具有吸水性
C.盐酸具有挥发性
D.气体溶质的溶解度随温度升高而降低
参考答案:A
本题解析:浓硫酸的脱水性是指浓硫酸把有机物的H、O两元素按原子个数比2:1的比例脱出来,形成水分子。而吸水性是指吸收现成的水分子,包括水蒸汽、湿存水和结晶水
本题难度:简单
4、填空题 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
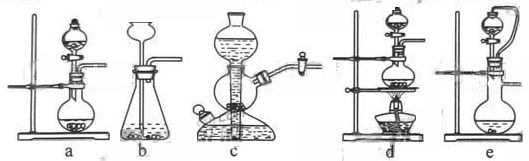
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是?????????(填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠??????g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠???????g(保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。
石灰—石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为:SO2+Ca(OH)2=CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O=2CaSO4·2H2O。其流程如下图:
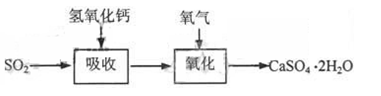
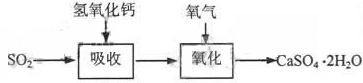
碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:

已知:
试剂
| Ca(OH)2
| NaOH
| 价格(元/kg)
| 0.36
| 2.9
| 吸收SO2的成本(元/mol)
| 0.027
| 0.232
?
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是?????????????????。和碱法相比,石灰-石膏法的优点是?????????????,缺点是????????????????。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
参考答案:
 本题解析:(1)用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率,结合装置可知a、e可达到目的; 本题解析:(1)用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率,结合装置可知a、e可达到目的;
(2)???? H2SO4+Na2SO3=Na2SO4+SO2+H2O
126g???????? 22.4L
m?????????? 3.36L
m=18.9g
4g亚硫酸钠被氧化为硫酸钠后的质量变为4.5g,则有4.0%亚硫酸钠被氧化为硫酸钠的样品中,亚硫酸钠的质量分数为95.5%,因此称取样品的质量为19.8g。
(3)石
本题难度:一般
5、填空题 (16分)硫及其化合物有如下转化关系

(1)发生氧化还原反应的是????????????????????(填序号)
(2)写出(5)的反应方程式?????????????????????????????????????????????????????,
说明浓硫酸具有???????????,制取CuSO4,??????????方法最好(填序号),
(3)SO2是造成空气污染,形成酸雨的主要物质。SO2在水的存在下与氧气反应生成硫酸,反应方程式为??????????????????????????????????????????????????????。
验证二氧化硫的方法是?????????????????????????????????????????????????????。
(4)某溶液中含有Cl-、SO42-,可能含有Na+、Fe2+或其中一种。
①验证Cl-、SO42-的方法是??????????????
A.先加BaCl2溶液,等沉淀后,再加AgNO3溶液
B.先加AgNO3溶液,等沉淀后,再加BaCl2溶液
C.先加Ba(NO3)2溶液,等沉淀后,再加AgNO3溶液
②验证Na+或Fe2+最简单的方法是??????????????????????????????????????????。
参考答案:(16分)
(1) (1)(2)(5)??
本题解析:略
本题难度:简单
|
|