微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1 NaHSO4溶液:K+、Fe2+、NO3-、Cl-
B.0.1 mol·L-1NaAlO2的溶液:K+、Na+、SO42-、CO32-
C.无色溶液:Ba 2+、Na+、MnO4-、NO3-
D.由水电离出的c(OH-)=1.0×10-12 mol·L-1的溶液:NH4 +、HCO3-、Na+、Cl-
参考答案:B
本题解析:
试题分析:A.0.1 mol·L-1 NaHSO4溶液是强酸性溶液,会发生反应:3Fe2++NO3-+4H+= 3Fe3++NO↑+2H2O。不能大量共存。错误。B.0.1 mol·L-1NaAlO2的溶液,离子K+、Na+、SO42-、CO32-不会发生任何反应,可以大量共存。正确。C.MnO4-是紫色的,在无色溶液中不能大量存在。错误。D.常温下纯水电离出的c(OH-)=1.0×10-7mol/L.现在由水电离出的c(OH-)=1.0×10-12 mol·L-1的溶液,说明该溶液可能是酸性溶液
本题难度:一般
2、填空题 (1)有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时丙为负极;把乙、丁分别浸入稀硫酸中,丁产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出。这四种金属的活动性由强到弱的顺序是?????????????????。
(2)向5mLNaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度大小关系为_______________。
(3) 现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是_______________
①20 mL 0.01 mol·L-1KCl溶液
②30 mL 0.02 mol·L-1CaCl2溶液
③40 mL 0.03 mol·L-1HCl溶液
④10 mL蒸馏水
⑤50 mL 0.05 mol·L-1 AgNO3溶液
(4)某种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。此电池的负极发生的电极反应式是_______________?????????????????????;
(5)某酸H2B在水溶液中有如下变化:H2B H++HB-;HB-
H++HB-;HB- H++B2-;现有溶液??????????????????????????? 0.10mol/L、100ml,试回答以下问题:
H++B2-;现有溶液??????????????????????????? 0.10mol/L、100ml,试回答以下问题:
①溶液中的H+物质的量取值范围是:????????????????????????
②已知0.1mol·L-1NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度可能是?????????0.11 mol·L-1(填“<”,“>”,或“=”)
参考答案:(1) 丙丁乙甲
(2)AgCl>AgI>
本题解析:
试题分析:(1)金属性强弱体现在与酸反应时的剧烈程度,组合成原电池时两极的现象,及金属间的置换反应;(2)向某难溶物的溶液中滴加其他溶液时可生成溶解度更小的物质;(3)由同离子效应可确定AgCl在不同溶液中的溶解度大小顺序为④>①>③>②>⑤;(4)甲醇燃料电池的负极物为甲醇,反应式为2CH3OH+2H2O-12e-=2CO2+12H+;(5)H2B在水溶液中电离方程式可知,H2B为强酸,HB-为弱酸,所以溶液H+的物质的量范围为0.01<n(H+)<0.02?
本题难度:一般
3、选择题 下列各组离子,在强碱性溶液中可以大量共存的是( )
A.Na+、Ba2+、Cl-、SO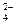
B.Na+、Ba2+、AlO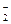 、NO
、NO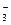
C.NH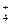 、K+、Cl-、NO
、K+、Cl-、NO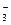
D.Na+、K+、NO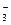 、SiO
、SiO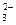
参考答案:BD
本题解析:A中硫酸根离子和钡离子不能大量共存,C中NH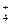 不能在强碱性条件下大量存在。
不能在强碱性条件下大量存在。
本题难度:简单
4、选择题 在酸性溶液中,能大量共存的离子是? (?? )
A.Mg2+、Fe3+、NO3-、OH-
B.Al3+、Fe2+、Cl-、SO42-
C.K+、Na+、Cl-、HCO3-
D.Na+、Ba2+、NO3-、SO42-
参考答案:B
本题解析:A错误,在酸性条件下,氢氧根离子不能大量共存。
B正确。
C错误,在酸性条件下,碳酸氢根离子不能大量共存。
D错误,钡离子不能和硫酸根离子大量共存。
本题难度:简单
5、填空题 (1)pH=13的CH3COONa溶液加水稀释100倍后,pH________11(填“>”“=”或“<”)原因是______________________________________________(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH________NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c( )由大到小的顺序为________;
)由大到小的顺序为________;
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH)=c(Cl-),则混合后溶液呈________性,盐酸的体积________氨水的体积(填“>”“=”或“<”);
(5)NaHSO4在水中的电离方程式为NaHSO4=Na++H++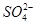 。该溶液中c(H+)_________________________c(OH-)+c(
。该溶液中c(H+)_________________________c(OH-)+c(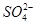 )(填“>”“=”或“<”)。
)(填“>”“=”或“<”)。
参考答案:(1)> 加水稀释使平衡CH3COO-+H2O
本题解析:(1)首先写出CH3COO-+H2O CH3COOH+OH-,加水稀释,假设平衡不移动,那么c(OH-)=10-1mol·L-1÷100=10-3mol·L-1,但平衡右移,c(OH-)应比10-3mol·L-1大,所以最终溶液中c(OH-)>10-3mol·L-1
CH3COOH+OH-,加水稀释,假设平衡不移动,那么c(OH-)=10-1mol·L-1÷100=10-3mol·L-1,但平衡右移,c(OH-)应比10-3mol·L-1大,所以最终溶液中c(OH-)>10-3mol·L-1
本题难度:一般