微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 A、B、C、D是原子序数依次增大的四种短周期元素,它们都可以在氧气中燃烧,生成的四种氧化物中有二种可溶于盐酸,三种可溶于氢氧化钠。将它们的单质溶于盐酸后过滤,向滤液中加过量的氢氧化钠,有白色沉淀生成;另将其单质溶于氢氧化钠,过滤,向滤液中加过量的盐酸,也可以得到白色沉淀,已知A、D同主族,则A为[???? ]
A.碳
B.钠
C.硅
D.硫
参考答案:A
本题解析:
本题难度:一般
2、填空题 下图是元素周期表中的一部分.
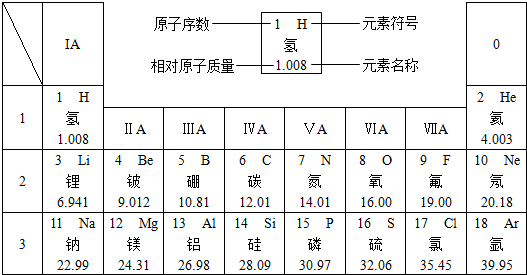
在元素周期表中,同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强.
请回答:
(1)硅的相对原子质量为______;原子序数为8的元素位于元素周期表的第______周期,元素符号为______,它属于______(填“金属”或“非金属”)元素.
(2)原子半径:钠______镁(填“>”或“=”或“<”,下同),原子得电子能力:硫______氯.
参考答案:(1)元素周期表中,元素符号下方的数字代表元素的相对原子质量
本题解析:
本题难度:简单
3、选择题 下列排序不正确的是
A.原子半径:钠>硫>氯
B.最高价氧化物对应的水化物的酸性:H3PO4C.最高正化合价:氯>硫>磷
D.热稳定性:碘化氢>溴化氢>氯化氢
参考答案:D
本题解析:A 正确,钠、硫、氯为同一周期元素,从左到右半径逐渐减小
B 正确,P、S、Cl非金属性逐渐增强,最高价含氧酸的酸性也逐渐增强。
C 正确,P、S、Cl最外层电子数逐渐增大,最高正化合价也逐渐增大。
D 错误,非金属性越强,氢化物的稳定性就越强,应该是碘化氢<溴化氢<氯化氢
本题难度:一般
4、填空题 a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
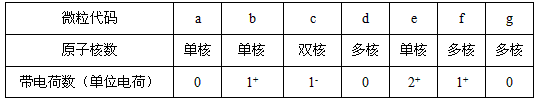
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。试写出:
(1)a微粒的核外电子排布式________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为 ______> ______(用化学式表示)。
(3)d溶于水的电离方程式___________。
(4)g微粒所构成的晶体类型属_________。
(5)c微粒是_________,f微粒是___________(用化学式表示)。
参考答案:(1)1s22S22p6
(2)NaOH>Mg
本题解析:
本题难度:一般
5、选择题 下列各组元素性质的递变错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素的最高正化合价依次升高
C.B、C、N、O、F原子半径依次增大
D.Be、Mg、Ca、Sr、Ba的失电子能力依次增强
参考答案:A、Li、Be、B三种元素原子位于第二周期,电子层数相同,最
本题解析:
本题难度:简单