微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组离子在指定溶液中一定能大量共存的是
A.发生析氢腐蚀的溶液中:NH4+、Ba2+、AlO2-、Cl-
B.c(H+)/ c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
C.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
D.甲基橙呈红色的溶液中:Na+、CO32-、Fe3+、Cl-
参考答案:B
本题解析:
试题分析:A.发生析氢腐蚀的溶液中呈酸性,含有H+,与AlO2-不能大量共存,错误;B.c(H+)/ c(OH-)=1012的溶液中显酸性,NH4+、Al3+、NO3-、Cl- 能大量共存,正确;C.由水电离的c(H+)=1×10-14mol·L-1的溶液中,水的电离被抑制,溶液呈酸性或碱性, HCO3-不能大量共存,错误;D.甲基橙呈红色的溶液中,溶液呈酸性,CO32-不能大量共存,错误。
本题难度:一般
2、选择题 常温下,下列各组溶液中的离子一定能大量共存的是( )
A.c(H+)=
Kw
的溶液:K+、Al3+、Cl-、HCO3-
B.c(H+)=10-12mol?L-1的溶液:ClO-、Ca2+、Mg2+、NO3-
C.pH=2的溶液:Fe2+、SO42-、K+、NO3-
D.滴入石蕊变红色的溶液:NH4+、Cl-、Na+、SO42-
参考答案:A.c(H+)=
本题解析:
本题难度:一般
3、填空题 下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃)。
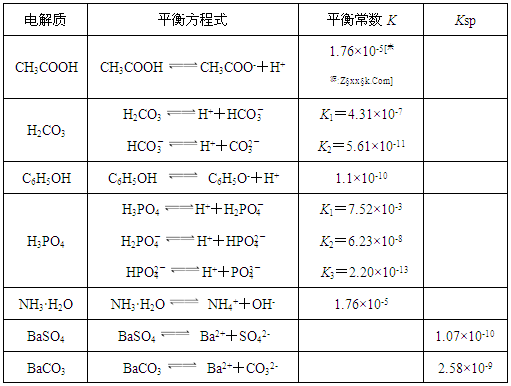
回答下列问题:
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为?????(须填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式:?????;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)?????
c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10ml 0.01mol/L苯酚溶液中滴加Vml 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是?????;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c((NH4+) >c (C6H5O-) >c (H+)>c (OH-)
C.V=10时,混合液中水的电离程度小于10 91eXaM.orgml 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (NH4+)= c (C6H5O-)+ c (C6H5OH)
(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式?????。
(6)Ⅰ.如下图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
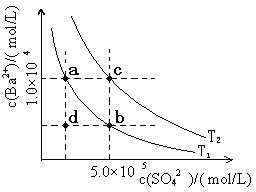
① T1?????T2(填>、=、<),
T2温度时Ksp(BaSO4)= ??????;
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是?????
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
Ⅱ.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为 1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理?????次。[提示: BaSO4(s)+ CO32- (aq) 1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理?????次。[提示: BaSO4(s)+ CO32- (aq) BaCO3(s)+ SO42- (aq) ] BaCO3(s)+ SO42- (aq) ]
参考答案:(16分)
(1)①④③②
(2)C6H5OH
本题解析:略
本题难度:一般
4、选择题 下列离子或分子组中能大量共存,且满足相应要求的是 ( )
参考答案:C
本题解析:
试题分析:MnO4-在溶液中是显紫红色的,A不正确;B中铁离子能氧化碘离子,也能和HCO3-反应生成氢氧化铁和CO2,B不正确;C中首先生成氢氧化铜沉淀,然后沉淀溶解在氨水中,C正确;D中加入的氢氧化钠首先和醋酸反应,然后在生成氨气,D不正确,答案选C。
考点:考查离子共存的正误判断
点评:离子不能大量共存的一般情况是(1)能发生复分解反应的离子之间(即生成沉淀,气体,水、弱酸、弱碱等难电离物质)。(2)能生成微溶物的离子之间(如:Ca2+和 SO42-;Ag+和 SO42-)。(3)能完全水解的离子之间,如多元弱酸和弱碱盐的阴、阳离子(如:Al3+, Fe3+与 CO32-、HCO3-、AlO2-、ClO-,S2-等)。(4)能发生氧化还原反应的离子之间(如:Fe 、H+、NO3-;S2-、ClO-;S2-、 Fe3+等)。(5)能发生络合反应的离子之间(如 Fe3+和 SCN-)。解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或 OH-。(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在。(3)溶液的具体反应条件,如“氧化还原反应”“加入铝粉产生氢气” 。(4)是“可能”共存,还是“一定”共存。
本题难度:困难
5、选择题 以下各组离子在该溶液中能大量共存的有
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、CO32- 、I-
B.pH值为1的溶液:Cu2+、Na+、Mg2+、NO3-
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Cl-、Ba2+
D.所含溶质为Na2CO3的溶液:K+、Na+、NO3-、Al3+
参考答案:B
本题解析:
试题分析:滴加石蕊试液显红色的溶液,说明该溶液呈现酸性,存在大量的H+,则H+与CO32-反应生成CO2,故不能大量共存于溶液中,且Fe3+与I-会发生氧化还原反应:2Fe3++2 I-="=" I2+2Fe2+,故A项错误;水电离出来的c(H+)=10-13mol/L<10-7 mol/L,故抑制了水的电离,该溶液应为强酸性或强碱性,无论酸性还是碱性HCO3-均不会大量存在,故C项错误;所含溶质为Na2CO3的溶液中,2Al3++ 3CO32-+3H2O==2Al(OH)3↓+3CO2↑,故D项错误;B项pH值为1的溶液即溶液中存在大量H+,酸性条件下Cu2+、Na+、Mg2+、NO3-均不发生化学反应,故能大量共存于溶液中,B项正确。
考点:离子共存问题。
本题难度:困难
|