微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 根据下图所示实验,填空和回答问题。

(1)烧瓶中所发生的主要反应的化学方程式是___________;装置(乙)的烧杯中冷水所起的作用是___________;装置(丙)的烧杯中液体的作用是___________。
(2)进行此实验时,烧杯内的橡皮塞最好用铝箔包住,用橡皮管连接的两玻璃管口要相互紧靠,这是因为___________,装置(丙)的烧杯中使用倒置漏斗可防止液体倒吸,其原因是___________。
参考答案:(1)2NaBr+MnO2+3H2SO4 本题解析:浓H2SO4具有强氧化性,能把HBr氧化成单质Br2,Br2能腐蚀橡胶,故橡胶用铝箔包好。
本题解析:浓H2SO4具有强氧化性,能把HBr氧化成单质Br2,Br2能腐蚀橡胶,故橡胶用铝箔包好。
本题难度:简单
2、选择题 在自来水生产过程中,常需要在水中加入明矾,其作用是
A.对水进行消毒
B.将水中悬浮物沉淀
C.把硬水变成软水
D.增加对人体有益的微量元素
参考答案:B
本题解析:明矾水解生成的氢氧化铝属于胶体,具有吸附作用。
本题难度:简单
3、计算题
(1)S(Na2CO3)与a的关系式,S=_____________(S代表溶解度)。
(2)a的取值范围。
参考答案:
(1) S= 本题解析:(1)最后所得晶体质量为(a+1.06)g,其中含Na2CO3质量是:106(a+1.06)/286 g,含水质量为:180(a+1.06)/286 g;则:
本题解析:(1)最后所得晶体质量为(a+1.06)g,其中含Na2CO3质量是:106(a+1.06)/286 g,含水质量为:180(a+1.06)/286 g;则:
S=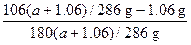 ×100 g=
×100 g= 本题难度:一般
本题难度:一般
4、实验题 Ⅰ、已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中共有KCl.Cl2.H2SO4.H2O.KMnO4.MnSO4.K2SO4七种物质:
(1)该反应中,化合价升高的反应物是 。
(2)写出一个包含上述七种物质的氧化还原反应方程式:
(3)上述反应中,氧化剂是 ,1 mol氧化剂在反应中得到 mol电子。
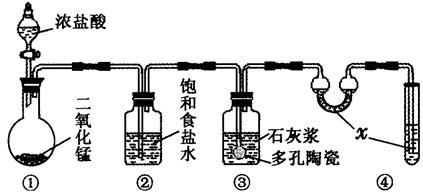
Ⅱ、某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数测定
 ?
?
(1)装置④中的x试剂为????????。
(2)装置③中发生反应的化学方程式为???????????????????????????。该反应是放热反应,反应温度较高时有副反应发生。改进该实验装置以减少副反应发生的方法是?????????
_________________________。
(3)测定漂白粉有效成分的质量分数
称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.1000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:
3ClO-+ I- =? 3Cl-+ IO3-??? IO3- + 5I- + 3H2O? =? 6OH- + 3I2 ?????????????
实验测得数据如下表所示。
滴定次数
| 1
| 2
| 3
|
KI溶液体积/mL
| 19.98
| 20.02
| 20.00
?
该漂白粉中有效成分的质量分数为????????。若滴定过程中未充分振荡溶液局部变浅蓝色时就停止滴定,则测定结果将?????????(填“偏高”、“偏低”或“无影响”)
参考答案:Ⅰ、(1)KCl(1分)
(2)2KMnO4+10KC
本题解析:
试题分析:Ⅰ、根据题意可知含七种物质的氧化还原反应为2KMnO4+10KCl+8H2SO4=6K2SO4+2MnSO4+5Cl2+8H2O,化合价升高的物质为KCl;氧化剂为KMnO4?;??1mol氧化剂得电子5mol ;
Ⅱ、因为氯气有毒,所以x试剂为NaOH,吸收多余的氯气;装置③制取漂白粉,反应为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O;为避免温度较高时发生副反应,可将装置③放于冷水浴中进行实验;(3)反应中消耗的KI的平均体积为20.00mL,其物质的量为
本题难度:困难
5、选择题 下列实验现象描述正确的是[???? ]
A.碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色
B.红热的铜丝在氯气中燃烧,产生了棕黄色的烟雾
C.电解氯化钠饱和溶液,将阴极气体产物通入碘化钾淀粉溶液中,溶液变蓝
D.溴化钠溶液中加入少量新制的氯水振荡,再加入少量四氯化碳振荡,静置后上层颜色变浅,下层颜色变为橙红色
参考答案:D
本题解析:
本题难度:一般
|