微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 NA为阿伏加德罗常数,下列说法正确的是
A.标准状况下,22.4?L?CO2和18?gH2O所含的分子数和原子数都相等
B.500?mL?1?mol?L-1AlCl3溶液中含有0.5?NA个Cl-
C.NA个N2分子所占的体积与0.5?NA个H2分子所占的体积比一定是2:1
D.某物质含有阿伏加德罗常数个微粒,该物质在标准状况下体积为22.4?L
参考答案:A
本题解析:分析:A.根据n= 计算二氧化碳的物质的量,根据n=
计算二氧化碳的物质的量,根据n=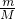 计算水的物质的量,结合分子含有原子数目,计算各分子含有的原子的物质的量,据此判断;
计算水的物质的量,结合分子含有原子数目,计算各分子含有的原子的物质的量,据此判断;
B.500?mL?1?mol?L-1AlCl3溶液中Cl-的浓度为3mol/L,根据n=cV计算氯离子的物质的量,再根据N=nNA计算氯离子数目;
C.分子数目一定,影响气体体积的因素有温度、压强,二者所处的温度、压强不一定相同;
D.根据物质可能的状态进行判断.
解答:A.二氧化碳的物质的量为 =1mol,含有原子的物质的量为1mol×3=3mol.水的物质的量为
=1mol,含有原子的物质的量为1mol×3=3mol.水的物质的量为 =1mol,含有的原子的物质的量为1mol×3=3mol,故二者含有原子数目相等,故A正确;
=1mol,含有的原子的物质的量为1mol×3=3mol,故二者含有原子数目相等,故A正确;
B.500?mL?1?mol?L-1AlCl3溶液中Cl-的浓度为3mol/L,氯离子的物质的量为0.5L×3mol/L=1.5mol,再根据N=nNA计算氯离子数目为1.5mol×NAmol-1=1.5NA,故B错误;
C.分子数目一定,影响气体体积的因素有温度、压强,若二者所处状态相同,则NA个N2分子所占的体积与0.5?NA个H2分子所占的体积比是2:1,但二者所处的状态不一定相同,故二者体积之比不一定是2:1,故C错误;
D.该物质不一定为气体,标准状况下,其体积不一定为22.4L,故D错误;
故选A.
点评:本题考查常用化学计量的有关计算,难度不大,注意气体摩尔体积的使用条件与对象.
本题难度:困难
2、选择题 某溶液中含有SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是
A.反应前后,溶液中离子浓度基本保持不变的只有Na+
B.有一种沉淀和两种气体产生
C.反应前后溶液颜色不发生变化
D.溶液中共发生了3个氧化还原反应
参考答案:A
本题解析:分析:某溶液中含有SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,SO32-可以被氯气氧化为硫酸根离子;SiO32-和氯水中的盐酸反应生成硅酸沉淀;Br-被氯气氧化为溴单质;CO32-和氯水中的盐酸反应生成二氧化碳气体.
解答:某溶液中含有SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,SO32-可以被氯气氧化为硫酸根离子;SiO32-和氯水中的盐酸反应生成硅酸沉淀;Br-被氯气氧化为溴单质;CO32-和氯水中的盐酸反应生成二氧化碳气体.
A.通过以上分析知,没有参加反应的离子是钠离子,所以反应前后,溶液中离子浓度基本保持不变的只有Na+,故A正确;
B.通过以上分析知,有一种沉淀和一种气体生成,故B错误;
C.通过以上分析知,反应前溶液呈无色,反应后有溴单质生成,溴水呈橙色,所以溶液由无色变为橙色,故C错误;
D.共发生了氯气氧化SO32-、Br-2个氧化还原反应,故D错误;
故选A.
点评:本题考查了氯水成分和离子反应的判断,明确氯气的氧化性、氯水中盐酸的作用是解答的关键,难度较大.
本题难度:简单
3、选择题 把vmL物质的量浓度为amol/L的FeCl3溶液加水稀释到2vmL后,该溶液中Cl-的物质的量是
A.
B.3av
C.
D.
参考答案:C
本题解析:分析:溶液稀释前后氯离子的浓度变化,氯离子的物质的量不变,等于vmL物质的量浓度为amol/L的FeCl3溶液中含有的氯离子的物质的量,根据氯化铁的化学式计算浓度为amol/L的FeCl3溶液中氯离子的浓度,再根据n=cV计算.
解答:浓度为amol/L的FeCl3溶液中氯离子的浓度为3amol/L,
所以vmL溶液中含有的氯离子的物质的量为V×10-3L×3amol/L=3aV×10-3mol.
故选C.
点评:本题考查物质的量浓度的计算,难度较小,注意溶液稀释前后溶质的物质的量不变.
本题难度:困难
4、选择题 设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是
A.1?mol甲烷中的氢原子被氯原子完全取代,需要2?nA?Cl2
B.1.5?mol?NO2与足量H2O反应,转移的电子数为2nA
C.常温常压下,46?g的NO2和N2O4混合气体含有的原子数为3nA
D.常温常压下,mg乙烯与mg丙烯中均含有()nA对共用电子对
参考答案:CD
本题解析:分析:A、取代反应的特征是有出有进,有机化合物中的氢原子被其他原子或原子团代替发生的反应;1mol氢原子需要1molCl2取代;
B、根据化学方程式计算电子转移数;
C、二氧化氮和四氧化二氮的组成元素相同,原子个数比相同,所以只需要计算46gNO2中 所含原子数即可;
D、质量换算物质的量,结合分子结构计算共价键物质的量,形成一个共价键需要两个电子;
解答:A、1?mol甲烷中含有4mol氢原子,4molCl2提供4mol氯原子发生取代反应,被氯原子完全取代,需要4?nA?Cl2,故A错误;
B、NO2与足量H2O反应的化学方程式为:3NO2+H2O=2HNO3+NO,每3molNO2反应转移电子物质的量为2mol,所以1.5?mol?NO2与足量H2O反应,转移的电子数为nA,故B错误;
C、NO2和N2O4的最简比相同,只需计算46gNO2中所含原子物质的量即可,46?g的NO2和N2O4混合气体含有的原子数为=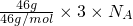 =3nA,故C正确;
=3nA,故C正确;
D、mg乙烯C2H4含有共价键即共用电子对物质的量=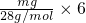 =
=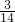 mol,mg丙烯C3H6中含有共价键即共用电子对物质的量=
mol,mg丙烯C3H6中含有共价键即共用电子对物质的量=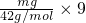 =
=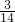 mol,所以,mg乙烯与mg丙烯中均含有(
mol,所以,mg乙烯与mg丙烯中均含有(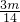 )nA对共用电子对,故D正确;
)nA对共用电子对,故D正确;
故选CD.
点评:本题考查了阿伏伽德罗常数的应用,氧化还原反应的电子转移数的计算,主要考查依据物质的量计算微粒数、共价键、共用电子对数的计算关系.
本题难度:困难
5、选择题 设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.1mol羟基与17?g?NH3所含电子数均为NA
B.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
C.在标准状况下,2.24L三氧化硫中所含分子数约为0.1NA
D.在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移2NA个电子
参考答案:D
本题解析:分析:A、质量换算物质的量结合取代基和分子式计算电子数;
B、硫酸溶液密度大于1,所以浓硫酸稀释,密度减小,溶液质量减少;
C、三氧化硫标准状况下不是气体;
D、根据化学方程式计算电子转移数;
解答:A、1mol羟基含有电子数为9mol,17?g?NH3物质的量为1mol,电子数为10mol,故A错误;
B、把浓硫酸稀释成稀硫酸密度变小了,100毫升的稀硫酸由于ρV=m,可见V=100时,ρ变小导致溶液质量m变小,而原溶质质量不变所以质量分数变大,所以应大于9.8%,故B错误;
C、三氧化硫标准状况下不是气体;在标准状况下,2.24L三氧化硫不是0.1mol,故C错误;
D、H2O2+Cl2═2HCl+O2反应中,氯气是氧化剂,过氧化氢是还原剂,电子转移H2O2~O2~2e-;所以每生成32g氧气,则转移2NA个电子,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的应用,主要考查取代基、分子式中的微粒数的计算,气体忙咯么人体积的条件应用,氧化还原反应的电子转移数的计算.
本题难度:困难