微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 现有以下物质:①NaCl晶体,②SO3,③冰醋酸,④铁丝,⑤BaSO4晶体,
⑥蔗糖,⑦乙醇,⑧熔融KNO3,请回答下列问题(填序号):
(1)以上物质中能导电的是????????????????;
(2)以上物质中属于非电解质,但其水溶液可以导电的是??????????????????;
(3)以上物质中属于弱电解质的是?????????????????????????????????;
参考答案:(1) mq?? (2) k?? (3) l
本题解析:
试题分析:氯化钠晶体不导电,氯化钠水溶液或熔融氯化钠能导电,氯化钠是电解质;SO3不导电,其水溶液能导电,但真正电离出自由移动离子的是H2SO4,SO3是非电解质;冰醋酸不导电,其水溶液能导电,冰醋酸是电解质;铁丝能导电,但铁丝是单质,既不是电解质也不是非电解质;BaSO4晶体不导电,熔化状态能导电,BaSO4是电解质;蔗糖和乙醇不导电,它们的水溶液及熔化状态都不导电,它们都是非电解质;熔融KNO3能导电,是电解质。
点评:电解质和非电解质都是化合物,电解质必须本身能电离出自由移动的离子。
本题难度:简单
2、选择题 将0.05 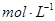 的醋酸溶液加水稀释时,下列说法正确的是(??? )
的醋酸溶液加水稀释时,下列说法正确的是(??? )
A.溶液中氢氧根离子的浓度增大了
B.c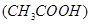 减小,电离平衡向生成醋酸分子的方向移动?
减小,电离平衡向生成醋酸分子的方向移动?
C.平衡向电离的方向移动,氢离子的浓度增大,醋酸分子的数量减少
D.电离程度增大,c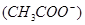 也增大了
也增大了
参考答案:A
本题解析:
试题分析:醋酸是弱酸,存在电离平衡CH3COOH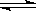 CH3COO-+H+。稀释促进电离,氢离子的个数增加,但氢离子浓度降低,,所以溶液中氢氧根离子的浓度增大,A正确,B和C以及选项D都是错误的,答案选A。
CH3COO-+H+。稀释促进电离,氢离子的个数增加,但氢离子浓度降低,,所以溶液中氢氧根离子的浓度增大,A正确,B和C以及选项D都是错误的,答案选A。
考点;考查外界条件对电离平衡的影响
点评:在稀释醋酸时,需要搞清楚促进电离,但溶液的酸性不
本题难度:一般
3、填空题 对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA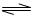 H++A
H++A
参考答案:
本题解析:
本题难度:困难
4、填空题 (18分)、现有下列物质:①H2S、②NH3、③H2SO4、④NaHCO3、
⑤CH3COOH、⑥KNO3溶液、⑦盐酸、⑧酒精、⑨二元酸H2A等。请回答下列问题(请填入序号)。
(1)其中一定属于弱电解质的是 。不能确定的是 ,请设计一个实验以证明它是强电解质还是弱电解质。你的实验和结论是
;
(2)H2S在水中的电离方程式为 __________;
NaHCO3在水中的电离方程式为 ;
 已知H2A的电离方程式为:H2A ="=" H++HA-; HA- H++A2-。试判断H2A是 电解质(填“强”或“弱”)。
已知H2A的电离方程式为:H2A ="=" H++HA-; HA- H++A2-。试判断H2A是 电解质(填“强”或“弱”)。
(3)2mol/L的盐酸和2mol/L的醋酸各100ml,分别与过量的Zn反应,生成H2的体积,V(盐酸) V(醋酸)(填>、=或<);氢离子浓度相等的盐酸和醋酸各100ml,分别与过量的Zn反应,生成H2的体积V(盐酸) V(醋酸) (填>、=或<);理由是
;
 (4)已知CH3COO-+H+ CH3COOH;现要使平衡向右移动且氢离子浓度增大,应采取的措施是( )
(4)已知CH3COO-+H+ CH3COOH;现要使平衡向右移动且氢离子浓度增大,应采取的措施是( )
A.加NaOH
B.加盐酸
C.加水
D.升高温度
已知CH3COOH在溶剂A中可以全部电离,盐不溶解于A溶剂。则CH3COOH在溶剂A中的电离方程式为 ;CH3COOH和Na2CO3在溶剂A中生成CO2反应的离子方程式是 &# 160; 。
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
5、填空题 (8分)一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,
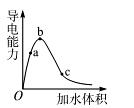
(1)O点导电能力为0的理由是???????????????????????。
(2)a、b、c三点溶液的c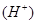 由小到大的顺序是?????????????。
由小到大的顺序是?????????????。
(3)a、b、c三点醋酸的电离程度最大的是?????????????????。
(4)要使c点c 增大,c
增大,c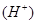 减少,可采取的措施是(至少写出三种方法)
减少,可采取的措施是(至少写出三种方法)
①????????;②????????;③????????。
参考答案:(8分) (1) (1分)在O点醋酸未电离,无自由离子存在<
本题解析:
试题分析:(1)冰醋酸在O点未能电离,不存在自由移动的离子,因此导电性未0。
(2)溶液的导电性越强,溶液中氢离子浓度越大,所以a、b、c三点溶液的c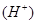 由小到大的顺序是c<a<b。
由小到大的顺序是c<a<b。
(3)醋酸是弱酸,存在电离平衡,稀释促进电离。所以a、b、c三点醋酸的电离程度最大的是c点。
本题难度:一般