微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 既能用浓硫酸又能用碱石灰干燥的气体是
A.Cl2
B.SO2
C.CO
D.NH3
参考答案:C
本题解析:
试题分析:A、氯气是酸性气体,只能用浓硫酸干燥,A不正确;B、SO2也是酸性气体,只能用浓硫酸干燥,B不正确;C、CO与浓硫酸和碱石灰都不反应,可以用来干燥,C正确;D、氨气是碱性气体,不能用浓硫酸干燥,D不正确,答案选C。
本题难度:一般
2、选择题 下列各组物质中,都能使溴水褪色的是?????????????????????
A.石灰水、乙醇、裂化汽油、天然橡胶单体
B.乙炔、纯碱溶液、油酸、乙二酸溶液
C.苯酚溶液、氨水、K2SO4溶液、KNO3溶液
D.SO2、氢硫酸、KI溶液、苯
参考答案:B 、D
本题解析:B.乙炔、油酸(顺式-十八烯-[9]-酸)与溴发生加成反应,溴在纯碱溶液中歧化,乙二酸可被溴氧化; D.SO2、H2S、K I可被Br2氧化,在催化剂(FeCl3)存在下苯与溴发生取代反应。
本题难度:一般
3、实验题 研究性学习小组进行SO2的制备及性质探究实验。
(1)根据反应Na2SO3(g)+H2SO4(浓)====Na2SO4+SO2↑+H2O,制备SO2气体。
(2)有一小组在实验中发现,SO2产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。
请你推测可能的原因并说明相应的验证方法(可以不填满)。
①原因:____________________,
验证方法:________________________________________。
②原因:____________________,
验证方法:________________________________________。
③原因:____________________,
验证方法:________________________________________。
参考答案:①Na2SO3变质 取待测试样于试管中,加入适量蒸馏水配成溶
本题解析:Na2SO3易氧化变质;SO2在水中有较大溶解度,应选较浓硫酸以减小SO2的溶解损失。
本题难度:简单
4、选择题 下列实验操作不正确的是(???)
A.用浓硫酸配制一定浓度的稀硫酸时,用量筒量取浓硫酸倒入盛水的烧杯中稀释,且用水洗涤量筒,洗涤液一并注入烧杯。
B.除去Fe(OH)3胶体中混有的Cl-离子,可用渗析的方法
C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出
D.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热
参考答案:A
本题解析:
试题分析:A浓硫酸密度比水大,溶于水放出大量的热,所以稀释时要注酸入水。但不能用水洗涤量筒。否则溶质的物质的量偏多。错误。B根据胶体的分散质微粒的直径比溶液大,利用渗析法提纯胶体。正确。C.分液时下层液体从下口放出,上层液体从上口倒出。正确。D.溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热,利用余热将少量水分蒸发掉。正确。
本题难度:一般
5、实验题 某学习小组的三位同学为测定镀锌铁皮的镀层的厚度,提出了各自的设计方案。(忽略锌镀层的氧化)甲同学的方案:先用盐酸将镀锌铁皮表面的锌反应掉,通过差量计算出锌的质量,然后再由锌的密度算出锌层的体积,最后由体积除以镀锌铁皮的面积计算得到锌层的厚度。
(1)甲同学的方案是否可行,说出理由:??????????????????????????????????????????????????????。
乙同学的方案:通过查阅资料,知道Zn(OH)2既可以与酸也可与碱反应,于是设计了如下方案:

(2)配制5%的盐酸1 L (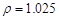 g/cm3 ),需取用36.5% (
g/cm3 ),需取用36.5% (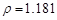 g/cm3 )的盐酸?????????mL
g/cm3 )的盐酸?????????mL
(保留一位小数)。
(3)若使用的镀锌铁皮的质量为28.357g,最后称得灼烧后固体的质量为40.000g,镀锌铁皮的长5.00cm,宽5.00cm,锌的密度为7.14g/cm3,则锌层的厚度为??????????cm。丙同学的方案:通过如图所示装置,测量镀锌铁皮与稀H2SO4反应产生气体的质量来计算锌层的厚度。己称得镀锌铁皮质量为18.200g。

(4)实验所用称量仪器为?????????????????????。
(5)若改用浓盐酸,则测出锌的厚度会??????????????(填“偏大”、“偏小”、或“无影响”)。
(6)实验后,将乙同学和丙同学的结果进行比较,发现他们对同种镀锌铁皮的测量结果差异很大,你认为谁的方案更加可靠呢????????理由是:?????????????????????????????????????。
参考答案:
(1)不可行??(1分)?? Fe也会和盐酸反应??
本题解析:
试题分析:
(2)解:设用36.5% (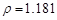 g/cm3 )的盐酸体积为X?????????
g/cm3 )的盐酸体积为X?????????
根据溶质不变:1.025*1000*5%=1.181*X*36.5%???????? X=118.9???
(3)解:设铁的质量为y
2Fe------- Fe2O3
112???160
y?????? 40.0????? y="28"
锌层的厚度:(m总-m铁)/p锌/5*5="(28.357-28)/" 7.14g*5*5=0.002(cm)因为镀上下两面,各面都是0.001 cm.
(5)偏小,因为盐酸挥发,损失一部分酸,根据酸量计算的锌量小。
(6)丙的方案是根据质量差来计算锌量,气体会带走水蒸气,造成的质量差误差很大。
本题难度:一般