微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述错误的是( )
A.生铁中含有碳,抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
D.铁管上镶嵌锌块,铁管不易被腐蚀
参考答案:A.生铁中含有碳,碳、铁和电解质溶液构成原电池,铁作负极而易
本题解析:
本题难度:一般
2、选择题 下列几种铁板,在镀层被破坏后,最耐腐蚀的是
[???? ]
A.镀锌铁板
B.镀铜铁板
C.镀锡铁板
D.镀铅铁板
参考答案:A
本题解析:
本题难度:简单
3、选择题 下列说法错误的是(?)
A.气态电中性基态原子失去电子转化为气态基态正离子需要的最低能量叫做第一电离能
B.当碳原子的核外电子排布由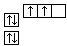 转变为
转变为 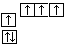 时,碳原子要向外界环境吸收能量
时,碳原子要向外界环境吸收能量
C.电负性的大小也可以作为判断金属性和非金属性强弱的尺度
D.同主族元素从上到下第一电离能逐渐变小
参考答案:A
本题解析:
试题分析:气态电中性基态原子失去一个电子转化为气态基态正离子需要的最低能量叫做第一电离能,A错误。B中碳原子从基态变为激发态,需要向外界吸收能量,B正确。电负性的大小可以作为判断金属性和非金属性强弱的尺度,C正确。同主族元素从上到下,最外层电子数相同,而原子半径逐渐增大,所以第一电离能逐渐变小,D正确。
点评:本题主要考查电离能的概念及应用,属于概念性理解,难度不大,侧重考查学生对概念的理解程度,细心程度。
本题难度:简单
4、选择题 某蓄电池放电、充电时反应为:Fe+ Ni2O3 +3H2O  Fe(OH)2 +2Ni(OH)2下列推断不正确的是(??)
Fe(OH)2 +2Ni(OH)2下列推断不正确的是(??)
A.放电时,Fe为正极,Ni2O3为负极
B.充电时,阴极上的电极反应式是:Fe(OH)2 +2e-→Fe+2OH-
C.放电时,负极上的电极反应式是:Ni2O3 +3H2O+2e-→2Ni(HO)2 +2OH-
D.该蓄电池的电极必须是浸在某种碱性电解质溶液中
参考答案:AC
本题解析:
试题分析:A、由放电时的反应可以得出铁做还原剂失去电子,Ni2O3做氧化剂得到电子,即正极为Ni2O3、负极为Fe,故A错误;
B、充电可以看作是放电的逆过程,即阴极为原来的负极,所以电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2,所以电池充电过程时阴极反应为Fe(OH)2+2e-=Fe+2OH-,故B正确;
C、根据总反应Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+,碱性电
本题难度:一般
5、填空题 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
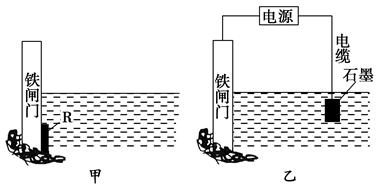
(1)为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用________(填字母)。
A.铜
B.钠
C.锌
D.石墨
(2)图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的________极。
参考答案:(1)C (2)负
本题解析:
试题分析:(1)铁闸门上连接一块比铁活泼的金属如锌,就可由锌失去电子,锌被溶解而铁被保护,属于牺牲阳极的阴极保护法。(2)属于外加电流的阴极保护法,需把被保护的铁闸门连接在电源的负极上。
本题难度:一般