微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其变化可表述为 __KClO3+__HCl(浓)——__KCl+__ClO2↑+___Cl2↑+___H2O
(1)配平上述化学方程式并用双线桥标出电子转移的方向和数目。
(2)氧化剂是________,还原剂是________;氧化产物是________,还原产物是________。
(3)浓盐酸在反应中显示出来的性质是________(填编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)产生0.1mol Cl2,则转移的电子的物质的量为________mol。
参考答案:18.
(1) 本题解析:
本题解析:
试题分析:(1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;所以KClO3系数为2,KCl系数为2,HCl系数为4,结合元素守恒,可知未知物是水,水的系数是2.电子转移的方向和数目为:
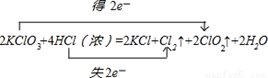
(2)反应2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各占一半.选:②.
(3))KClO3中氯元素化合价由+5价降低为ClO2中+4价,HCl中氯元素化合价由-1价升高为Cl2中0价,氧化剂是KClO3,还原剂是HCl;氧化产物是Cl2,还原产物是ClO2。
(4)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生0.1molCl2,转移的电子的物质的量为0.1mol×2=0.2mol.答案为:0.2mol.
考点:考查氧化还原反应的基本概念与配平。
本题难度:一般
2、填空题 向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式 。
(2)整个过程中的还原剂是 。
(3)把KI换成KBr,则CCl4层变为 色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(4)加碘盐中含碘量为20~50 mg·kg-1。制取加碘盐(含KIO3的食盐)1 000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)。
参考答案:(1)I2+5Cl2+6H2O=2HIO3+10HCl
本题解析:(1)CCl4层变成紫色说明有I2生成,继续滴加氯水变成无色,说明I2又被氧化生成HIO3,同时生成HCl。(2)首先KI被氧化生成I2,后来I2又被氧化生成KIO3,所以整个过程中的还原剂是KI、I2。(3)Br2的CCl4溶液显红棕色;继续滴加氯水,CCl4层颜色没有变化,说明氯水能氧化I2但不能氧化Br2,结合第(1)问可得氧化性HBrO3>Cl2>HIO3。(4)KI被Cl2氧化成KIO3,对应关系式为
I- ~ KIO3 ~ 3Cl2
1 mol 3 mol
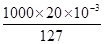 mol n(Cl2)
mol n(Cl2)
则n(Cl2)=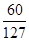 mol,V(Cl2)=
mol,V(Cl2)=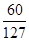 mol×22.4 L·mol-1≈10.58 L。
mol×22.4 L·mol-1≈10.58 L。
本题难度:一般
3、填空题 偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l)+2N2O4 (l)=2CO2 (g)+3N2(g)+4H2O(g)??????(I)
(1)反应(I)中氧化剂是_______。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g)  ?2NO2 (g)?(Ⅱ)?一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。
?2NO2 (g)?(Ⅱ)?一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。

若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(3)NO2可用氨水吸收生成NH4NO3。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是_____
_______________________________________________(用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5 mol·L-1,假设溶液的体积是bL)
参考答案:(每空2分,共14分)(1)N2O4???(2)? a、d?
本题解析:
试题分析:(1)根据反应(CH3)2NNH2 (l)+2N2O4 (l)=2CO2 (g)+3N2(g)+4H2O(g)可知,(CH3)2NNH2中氮元素的化合价从-2价升高到0价,N2O4中氮元素的化合价从+4价降低到0价,因此氧化剂是N2O4。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此可以判断。a、密度是混合气的质量和容器容积的比值,在反应过程中质量不变,但容器容积是变化的,因此当密
本题难度:一般
4、填空题 (7分)根据要求回答下列问题
(1) ________________________________??????(写名称)
________________________________??????(写名称)
(2)2-甲基-2-戊烯??????????????????????????????????????????????????????(写结构简式)
(3)键线式 表示的分子式??????????????????????????????????。
表示的分子式??????????????????????????????????。
(4)按官能团的不同,对有机物进行分类,请指出下列有机物的种类,填在横线上。
CH3CH2CH2Br? __________;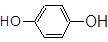 ___________;?????
___________;????? ________________;
________________; ________________;??????
________________;??????
参考答案:(1)2,3-二甲基戊烷??(2)(CH3)2C=CHCH2
本题解析:(1)根据有机物的结构简式可知,主链有5个碳原子,带两个支链,且都是甲基,所以名称是2,3-二甲基戊烷。
(2)根据名称可知,该有机物的结构简式为(CH3)2C=CHCH2CH3。
(3)将碳、氢元素符号省略,只表示分子中键的连接情况,每个拐点或终点均表示有1个碳原子,称为键线式。所以分子式为C6H14,名称是2-甲基戊烷。
(4)含有溴原子,则属于卤代烃。含有酚羟基,则是酚类。含有酯基则是酯类。含有羧基,则是羧酸类。
本题难度:一般
5、填空题 铜和浓硝酸反应生成NO2,当浓硝酸变稀后,则生成NO,3.84克铜和适量浓硝酸反应后,铜全部反应完,收集到标准状况下NO和NO2混合气体共2.24L,求:
(1)参与反应的HNO3的物质的量.
(2)生成的混合气体中NO的体积.
参考答案:3.84克铜的物质的量为
本题解析:
本题难度:一般