微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在某一化学反应中,反应物A的浓度在15 s内从3.0 mol/L变成1.5 mol/L,在这15 s内A的化学反应速率为
A.1.5 mol/(L·s)
B.1.5 mol/L
C.0.1 mol/(L·s)
D.0.1 mol/L
参考答案:C
本题解析: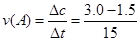 ="0.1" mol/(L·s)
="0.1" mol/(L·s)
本题难度:简单
2、选择题 下列依据热化学方程式得出的结论正确的是
A.已知2H2(g)+O2(g)=2H2O(l),△H=-483.6 kJ·mol
参考答案:
本题解析:
本题难度:一般
3、选择题 含有下列键型的物质,可能为单质的是
A.只有离子键的物质
B.既有离子键,又有非极性键的物质
C.既有极性键,又有离子键的物质
D.只有非极性键的物质
参考答案:D
本题解析:
试题分析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。所以含有离子键的物质一定是离子化合物。由于由同一种元素的形成的共价键是非极性键,所以选项D中一定是单质,答案选D。
点评:该题是中等难度的试题,主要是考查学生对化学键含义以及化学键与物质关系的熟悉了解程度,意在巩固学生的基础,提高学生的能力。有利于培养学生的逻辑推理能力和创新思维能力。
本题难度:一般
4、填空题 (6分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol液态 H2O2混合恰好完全反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)反应的热化学方程式为 。
(2)又已知16g液态肼与液态双氧水反应生成液态水时放出的热量是408 kJ。则H2O(g)=H2O(l)
的ΔH= 。
(3)已知N2(g) + 2O2(g) ="=" 2NO2(g);△H=+67.7KJ/mol,
N2H4(g) + O2(g) ="=" N2(g)+2H2O(g);△H= —534KJ/mol,
则肼与NO2完全反应的热化学方程式为_____ _____________________。
参考答案:(1)反应的热化学方程式为N2H4(g)+2H2O2(l)=
本题解析:
诗题分析:(1)0.4mol液态肼和0.8mol液态 H2O2混合恰好完全反应,生成氮气和水蒸气,放出256 kJ的热量。说明1摩尔液态肼与2摩尔液态过氧化氢反应恰好反应生成氮气和水蒸气,放出640 kJ,所有热方程式为N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)ΔH="-640" kJ·mol-1;(2)N2H4(g)+2H2O2(l)=N2(g)+4H2O(l)ΔH="-816" kJ·mol-1,根据盖斯定律分析,H2O(g)=H2O(l)的反应热等于[(-816)-(640)]/2=-44 kJ·mol-1;(3)根据盖斯定律,方程式二×2--方程式一,△H= 2×—534KJ/mol-(+67.7KJ/mol)=—1135.7KJ/mol.
考点:盖斯定律,热化学方程式的书写。
本题难度:一般
5、计算题 PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。
①已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g)??H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g)???H = -566.0 kJ/mol?????
H2O(g)=H2O(1)??H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从______(填“c”或“b”)口通入,电池负极反应式为__________________。
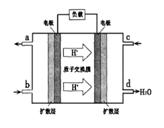
③25℃时,将甲醇燃烧生成的足量CO2通入到浓度为0.lmol·L-1,NaOH溶液中,所得溶液的pH=8,溶液中离子浓度由大到小的顺序是_________________。
(2)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)=N2O3(g),ΔH<0若该反应在绝热、恒容的密闭体系中进行,下列示意图能说明tl时刻达到平衡状态的是____________。

(3)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.l0molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=__________,若继续通入0.20mo1SO2和0.lmolO2,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(4)在一定条件下,NO2可以被NH3还原为N2来消除NO2对环境造成的污染。25℃时,将NH3溶于水得l00mL 0.lmol·L-的氨水,测得pH=11,则该条件下NH3·H2O的电离平衡常数约为___________。
参考答案:(16分)
(1)?①CH3OH(l)+O2(g)=
本题解析:
试题分析:
(1)①根据盖斯定律①-②-③×4得到CH3OH(l)+O2(g)=CO(g)+2H2O(l)?△H=-442.8kJ·mol-1。②结合图像电池中质子移向正极,O2在正极反应。应从c通入,发生O2+4e-+4H+=2H2O,所以负极为CH3OH+ H2O-6e-=CO2↑+6H+。③溶液的pH=8应为溶质为碳酸氢钠,离子浓度由大到小的顺序是c(Na+)> c(HCO- 3)> c(OH-)> c(H+)> c(CO2- 3)。
(2)达 到平衡状态
本题难度:一般