微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t?时到达平衡,依图所示:
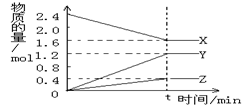
①该反应的化学方程式是 ????????。
②反应起始至t,Y的平均反应速率是?????????。
参考答案:(3分)(1)2X? 本题解析:
本题解析:
试题分析:(1)由图象可以看出,反应中X的物质的量减小,Y、Z的物质的量增多,则X为反应物,Y、Z为生成物.t时刻后,X的物质的量为定值且不为零,为可逆反应,且△n(X):△n(Y):△n(Z)=0.8mol:1.2mol:0.4mol=2:3:1,则反应的化学方程式为:2X?3Y+Z。
(2)在tmin时间内,用Y表示反应的平均速率v(Y)=△c(Y)÷△t="(1.2mol-0mo" l)÷2L÷ tmin=0.6/t mol/(L﹒min)mol/(L﹒min)。
点评:本题考查
本题难度:一般
2、选择题 影响化学反应速率的因素很多,下列措施一定能使化学反应速率增大的是( )
A.升高温度
B.增大压强
C.降低浓度
D.减小压强
参考答案:A
本题解析:化学反应速率受温度、浓度、压强、催化剂等外界条件下影响,但压强只对气体有作用
本题难度:一般
3、填空题 (7分)
(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有 和 。
(2)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
时间/min
| 1
| 2
| 3
| 4
| 5
|
体积/mL
| 50
| 120
| 232
| 290
| 310
①哪一时间段反应速率最大_______(填“0~1 min”或“1~2 min”或“2~3 min”或“3~4 min”或“4~5min”)。
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为________。
③试分析1~3min时间段里,反应速率变大的主要原因 。
(3)对于容积固定的反应:N2(g)+3H2(g)  2NH3(g)(正反应放热),达到平衡的标志有___ 。 2NH3(g)(正反应放热),达到平衡的标志有___ 。
A N2、H2、NH3的百分含量不再变化 B 总压强不变
C N2、H2、NH3的分子数之比为1∶3∶2 D N2、H2、NH3的浓度相等
E.N2、H2不再起反应 F.v(N2)=v(H2)
G.混合气体的密度不变 H.混合气体的平均相对分子质量不变
I.正反应放出的热量等于逆反应吸收的热量
参考答案:(1)温度、浓度;(2)①“2~3 min”② 0.1 mo
本题解析:
试题分析:(1)根据题意知,当加热或加入浓盐酸后,反应速率明显加快,说明温度升高、浓度增大,可增大反应速率,则影响化学反应速率的因素有温度和浓度;(2)①2~3min收集的气体的体积比其它时间段体积大,说明该时间段反应速率最大;②2~3min时间段生成氢气体积为232ml-120mL=112mL,n(H2)=0.005mol,则消耗n(HCl)=0.01mol,v(HCl)=0.1mol.L-1.min-1;③开始反应时浓度逐渐变小,温度逐渐升高,但反应速率逐渐增大,说明反应放热成为影响速率的主要因素。(3)对于容积固定的反应:N2(g)+3H2(g)  2NH3(g)(正反应放热),A.N2、H2、NH3的百分含量不再变化,已达平衡,正确;B.根据阿伏加德罗定律,总压强不变,容器内气体的总物质的量不变,该反应反应前后气体的物质的量不等,说明已达平衡状态,正确;C.N2、H2、NH3的分子数之比为1∶3∶2,不一定处于平衡状态,错误;D.N2、H2、NH3的浓度相等,不一定处于平衡状态,错误; E.化学平衡为动态平衡,N2、H2不再起反应,错误;F.v(N2)=v(H2),没有明确正逆反应速率,错误; G.混合气体的密度不随反应的进行而变化,密度不变不能说明已达平衡状态,错误;H.混合气体的平均相对分子质量不变,已达平衡状态,正确;I.正反应放出的热量等于逆反应吸收的热量,说明正逆反应速率相等,已达平衡状态,正确,选ABHI。 2NH3(g)(正反应放热),A.N2、H2、NH3的百分含量不再变化,已达平衡,正确;B.根据阿伏加德罗定律,总压强不变,容器内气体的总物质的量不变,该反应反应前后气体的物质的量不等,说明已达平衡状态,正确;C.N2、H2、NH3的分子数之比为1∶3∶2,不一定处于平衡状态,错误;D.N2、H2、NH3的浓度相等,不一定处于平衡状态,错误; E.化学平衡为动态平衡,N2、H2不再起反应,错误;F.v(N2)=v(H2),没有明确正逆反应速率,错误; G.混合气体的密度不随反应的进行而变化,密度不变不能说明已达平衡状态,错误;H.混合气体的平均相对分子质量不变,已达平衡状态,正确;I.正反应放出的热量等于逆反应吸收的热量,说明正逆反应速率相等,已达平衡状态,正确,选ABHI。
考点:考查化学反应速率、化学平衡状态的判断。
本题难度:一般
4、选择题 如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是:??????????????????????????????????????????????????????????????????????????????????????????
 [???? ] [???? ]
A.2SO2(g)+O2(g)? 2SO3(g)??ΔH<0 2SO3(g)??ΔH<0
B.4NH3(g)+5O2(g)? 4NO(g)+6H2O(g)??ΔH<0 4NO(g)+6H2O(g)??ΔH<0
C.H2(g)+I2(g)? 2HI(g)??ΔH> 0 2HI(g)??ΔH> 0
D.2A(g)+B(g) ?2C(g)??ΔH>0 ?2C(g)??ΔH>0
参考答案:B
本题解析:
本题难度:一般
5、实验题 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好 pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该 方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
实验设计
控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
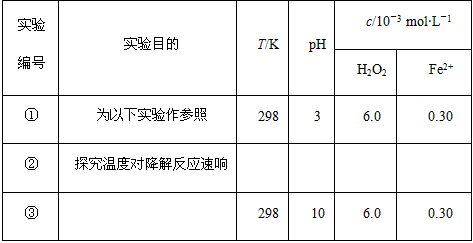

数据处理 实验测得p-CP的浓度随时间变化的关系如上图。
(2)请根据上图实验①曲线,计算降解反应50~150 s内的反应速率: v(p-CP)=________mol·L-1·s-1。解释与结论
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:________________________________________________________________________。
(4)实验③得出的结论是:pH等于10时,_______________________________。思考与交流
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:________。
参考答案:(1)![]()
本题解析:
本题难度:一般
|