微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题
A.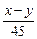
B.
C.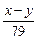
D.
参考答案:A
本题解析:此题利用某元素的相对原子质量是一定值来列式求解。x-62n=y-17n?n=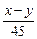 。
。
本题难度:一般
2、实验题 图中是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
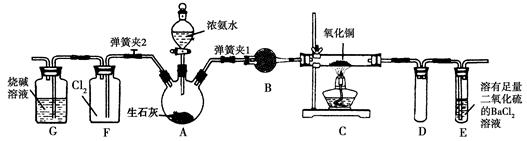
(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先________,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是________。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生________(答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:________________________。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16 g,反应后称重固体质量减少2.4 g,通过计算确定该固体产物的成分是_________
__________(用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中,写出产生白烟的化学方程式:____________________,迅速产生倒吸的原因是____________________________。
参考答案:(1)关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,在E中装入水
本题解析:A是制备NH3的装置,B是干燥NH3的装置,C是NH3与CuO的反应装置,E是处理NH3的尾气装置,F是NH3与Cl2的反应装置,G是处理尾气Cl2的装置。
(2)干燥NH3需使用碱性干燥剂。(3)C中CuO与NH3发生氧化还原反应生成红色的Cu、N2和H2O;E中发生反应:2NH3+BaCl2+SO2+H2O=BaSO3↓+2NH4Cl。(4)若产物全部是Cu,则由差量法知减小的部分全部是O元素的质量,即n(CuO)=n(O)=2.4 g÷16 g·mol-1=0.15 mol,所以反应的CuO的
本题难度:困难
3、选择题 物质的量之比为2︰5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A.1︰4
B.1︰5
C.2︰3
D.2︰5
参考答案:A
本题解析:
试题分析:当锌的物质的量为2mol时,生成硝酸锌的物质的量为2mol,未被还原的硝酸中硝酸根离子均存在于硝酸锌中,故未被还原的硝酸为4mol,反应掉的锌为5mol,被还原的为1mol,故被还原的硝酸与未被还原的硝酸的物质的量之比为1:4,;故选A。
本题难度:一般
4、实验题 某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生 NO。其实验流程图如下:
NO。其实验流程图如下:

⑴测定硝酸的物质的量
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为____________,则Ag与浓硝酸反应过程中生成的NO2的物质的量为______________。
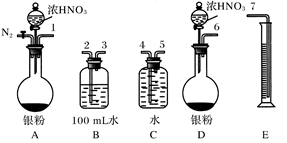
⑵测定NO的体积
①从上图所示的装置中,你认为应选用________装置进行Ag与浓硝酸反应实验,选用的理由是____________________________________________________________
________________________________________________________________________。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是_________________________(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置______(选填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
⑶气体成分分析
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中________(填“有”或“没有”)NO产生,作此判断的依据是__________________
________________________________________________________________________。
参考答案:(14分)⑴0.008 mol ??(2分)???? 0.0
本题解析:略
本题难度:一般
5、填空题 工业上制取硝酸铵的流程图如下,请回答下列问题:
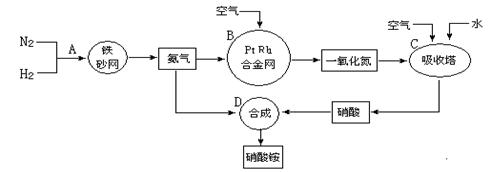
(1)在上述工业制硝酸的生产中,B设备的名称是?????????????,其中发生反应的化学方程式为????????????????????????????????????????????????????。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是??????????????。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

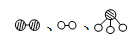 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是????????????????、????????????????????。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是????????????????、????????????????????。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是?????????????????????;在合成硝酸的吸收塔中通入空气的目的是??????????????????????????????。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2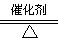 ?7N2+12H2O(NO也有类似的反应)
?7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是???????????????????????????????????。
(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 ??????%。
(6)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,应注意的事项及理由是:
?
| 注意事项
| 理由
|
①
| ?
| ?
|
②
| ?
| ?
?
参考答案:(1)氧化炉,(1分)????? 4NH3+5O2![]()
本题解析:
试题分析:(1)工业制硝酸用氨氧化法制取,其法以氨和空气为原料,用Pt—Rh合金网为催化剂在氧化炉中于 800℃进行氧化反应,生成的NO在冷却时与O2生NO2,NO2在吸收塔内用水吸收在过量空气中O2的作用下转化为硝酸,最高浓度可达50%。制浓硝酸则把50%HNO3与Mg[NO3]2或浓H2SO4蒸馏而得。反应的化学方程式分别为:4NH3+5O2 本题难度:一般 本题难度:一般
|