90.0
可见,t2℃时无水氯化铝存在形式的化学式为 ( )
A.AlCl3
B.AlCl3和Al2Cl6
C.Al3Cl9
D.Al2Cl6
参考答案:
B
本题解析:
根据公式:气体的摩尔质量=气体摩尔体积×密度
可以求出t2℃时无水氯化铝的摩尔质量=70.0×2.67=186.9
设无水氯化铝的化学式为(AlCl3)n,则n==1.4,介于1、2之间,因此,选B。
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数的值,下列叙述中正确的是?(???)
A.56g铁发生氧化还原反应,一定失去2NA个电子
B.18gD2O含有的质子数为10NA
C.常温常压下,46gNO2和N2O4的混合物中含有的原子数为3NA
D.1mol/L Na2CO3溶液中含有的Na+数目为2NA
参考答案:C
本题解析:A、Fe发生氧化还原反应,可能生成Fe2+、Fe3+,故失去电子数目可能为2NA或3NA;
B、D2O的摩尔质量为20g/mol,18g不为1mol;
D、未告诉体积,不能求出数目。
本题难度:一般
4、计算题 (8分)常温下,在27.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
(1)该溶液中CuSO4的物质的量浓度
(2)取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
参考答案:(1)1.51mol/L (2)30.2ml
本题解析:考查物质的量浓度溶液的有关计算。
(1)溶液的质量是27.5g+12.5g=40g
由于溶液的密度是1.21g/ml
所以溶液的体积是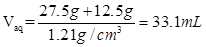
由于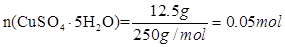
所以根据c=n/V可知,溶液的浓度是

(2)由于再稀释过程中,溶质的物质的量是不变的
所以稀释后溶液的体积是
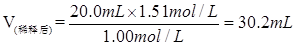 。 。
本题难度:一般
5、填空题 浓H2SO4密度1.84g/mL,物质的量浓度为18.4 mol/L , 质量分数为98% ,取10mL浓H2SO4和amL水混合得物质的量浓度为Cmol/L,质量分数为b%。下列组合正确的是
(1).若C=9.2则a>10 b>49% (2) 若C=9.2则a>10 b<49%
(3).若b=49则a=18.4 C<9.2 (4) 若b=49则a=18.4 C>9.2
A.(1) (3)
B.(1) (4)
C.(2) (3)
D.(2) (4)
参考答案:A
本题解析:
试题分析:若C=9.2,根据稀释定律,可知稀释后溶液的体积为20mL,硫酸的浓度越大,密度越大,故稀释后溶液的质量小于原浓硫酸质量的2倍,稀释过程硫酸的质量不变,故稀释后硫酸的质量分数大于49%,稀释过程中溶质硫酸的质量不变,则:10mL×1.84g/mL×98g%<(10mL×1.84g/mL+amL×1g/mL)×49%,解得a>18.4;若b=49,稀释过程中溶质硫酸的质量不变,则:10mL×1.84g/mL×98g%=(10mL×1.84g/mL+amL×1g/mL)×49%,解得a=18.4,令稀释后的密度为dg/mL,则d<1.84,稀硫酸的物质的量浓度C<9.2mol/L,选A。
考点:考查溶液浓度的有关计算。
本题难度:一般
|