微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 I、恒温下,将amolN2与bmolH2的混合气体通入一个固体容积的密闭容器中,发生如下反应:N2(g)+3H2(g)?2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a=______.
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%.计算平衡时NH3的物质的量______.
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)=______.
(4)原混合气体中,a:b=______.
(5)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)=______.
(6)平衡混合气体中,n(N2):n(H2):n(NH3)=______.
II、若向体积不变的密闭容器中充入2molN2和6molH2,一定条件下发生反应:
N2(g)+3H2(g)?2NH3(g),平衡时混合气共7mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
(1)若a=0,b=0,则c=______.
(2)若a=0.7,b=2.1,则:
①c=______.
②这时反应向______进行,因为:______.
③若要维持反应开始向该反应方向进行,c的范围是______.
(3)欲使起始反应维持向与②相反的方向进行,则b的范围是______.
参考答案:(1)由反应的化学方程式得知,反应掉的N2和生成NH3的物质
本题解析:
本题难度:一般
2、填空题 (6分)在80℃时,将0.40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应N2O4(g) 2NO2(g)△H=" +57" kJ·mol-1,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g)△H=" +57" kJ·mol-1,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s)
| 0
| 20
| 40
| 60
| 80
| 100
|
n(N2O4)/mol
| 0.40
| a
| 0.20
| c
| d
| e
|
n(NO2)/mol
| 0.00
| 0.24
| b
| 0.52
| 0.60
| 0.60
(1)计算a =??????????,此温度时该反应的平衡常数K=????????????;
(2)改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有(填序号)??????????。
A.增大N2O4的起始浓度?????? B.升高温度
C.使用高效催化剂??????????? D.向混合气体中通入稀有气体
参考答案:(1)a="0.28?????" 1.8 mol / L(无
本题解析:略
本题难度:一般
3、简答题 平衡问题是中学化学理论中的核心问题,请完成以下相关小题:
(1)若在某温度下向恒压容器中投入反应物A、B,当反应A(g)+3B(g)

2C(g)达到平衡时,测得容器中含有A?1mol?B?0.4mol,C?0.4mol,此时容积为2L.则A的起始投入量为______mol,平衡常数K=______,恒温恒压时,再向此容器内通入1.8mol?A,平衡将______?(填“正向”、“逆向”或“不”)移动.
(2)已知Ksp(BaSO4)≈1×10-10,Ksp(BaCO3)≈5×10-9,则饱和:BaSO4溶液中c(SO42-)mol?L-1,向BaSO4悬浊液中逐渐加入Na2CO3固体至c(CO32-)=______mol.L-1时,BaSO4开始向BaCO3沉淀转化.
(3)若25°C时某一元酸HA的电离平衡常数Ka=1×10-6,则相同温度下NaA的水溶液呈碱性的原因可用离子方程式表示为______,相同物质的量浓度的HA和NaA两溶液等体积混合后,溶液显______性(±真“酸”、“碱”或“中”).
参考答案:(1)达到平衡时,△n(C)=0.4mol,物质的量之比等于
本题解析:
本题难度:一般
4、填空题 钛(Ti)被称为继铁、铝之后的第三金属,也有人说21世纪是钛的世纪。钛在地壳中的含量并不少,但钛的冶炼技术还未获得突破,目前钛只用于尖端领域。
如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可大大提高资源利用率,减少环境污染。
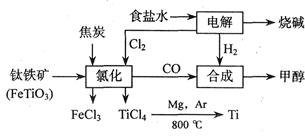
请填写下列空白:
(1)用惰性电极电解2 L食盐水时,总反应的离子方程式_______________________________,当阴极上产生224 mL气体(标准状况)时,所得溶液的pH=?????????????(假设电解前后溶液体积不变,食盐水足量)。
(2)写出高温下钛铁矿经氯化得到四氯化钛的化学方程式?????????????????????????????。(提示:FeTiO3中Ti为+4价)
(3)反应2Mg+TiCl4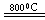 2MgCl4+Ti在Ar气氛中进行的理由是____________________。 2MgCl4+Ti在Ar气氛中进行的理由是____________________。
(4)二甲醚是一种重要的清洁燃料,可以通过甲醇分子间脱水制得:
2CH3OH(g)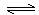 CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/mol CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/mol
T1 ℃时,在恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如下图所示。
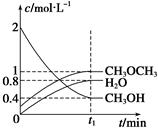
①T1 ℃时,该反应的平衡常数为 ;
②相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)="0.4" mol/L、c(H2O)="0.6" mol/L、(CH3OCH3)="1.2" mol/L,此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)。
(5)在上述产业链中,合成192吨甲醇理论上需额外补充H2__________吨 (不考虑生产过程中物质的任何损失)。
参考答案:(14分,每空2分)?(1)2Cl-+2H2O![]()
本题解析:
试题分析:(1)用惰性电极电解食盐水时,总反应的离子方程式是2Cl-+2H2O 2OH-+H2↑+Cl2↑。阴极是氢离子放电,生成氢气,氢气的物质的量是0.224L÷22.4L/mol=0.01mol,则根据方程式可知,生成的氢氧化钠是0.02mol,所以氢氧化钠溶液的浓度是0.02mol÷2L=0.01mol/L,则pH=12。 2OH-+H2↑+Cl2↑。阴极是氢离子放电,生成氢气,氢气的物质的量是0.224L÷22.4L/mol=0.01mol,则根据方程式可知,生成的氢氧化钠是0.02mol,所以氢氧化钠溶液的浓度是0.02mol÷2L=0.01mol/L,则pH=12。
(2)高温下碳的氧化产物是CO,所以钛铁矿经氯化得到四氯化钛的化学方程式是2FeTiO3+6C+7Cl2 2TiCl4+2FeCl3+6CO。 2TiCl4+2FeCl3+6CO。
(3)在高温下镁和钛均能和空气中的氧气或氮气或CO2反应,所以反应在Ar气氛中进行的理由是防止高温下Mg、Ti与空气中的O2(或CO2、N2)反应。
(4)①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据图像可知平衡时甲醚、水蒸气和甲醇的浓度分别是(mol/L)1、0.8、0.4,则该反应的平衡常数K=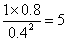 。 。
②某时刻各组分浓度依次为c(CH3OH)="0.4" mol/L、c(H2O)="0.6" mol/L、(CH3OCH3)="1.2" mol/L,此时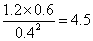 <5,所以正反应速率大于逆反应速率。 <5,所以正反应速率大于逆反应速率。
(5)根据由方程式CO(g)+2H2(g) CH3OH(g)、2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO和2NaCl+2H2O=2NaOH+H2↑+Cl2↑可得如下关系式:6CH3OH→6CO→7Cl2→7H2,而6CH3OH→12H2,故每生产6molCH3OH(192g)需额外补充5molH2(10g),则生产192t甲醇,至少需额外补充10t氢气。 CH3OH(g)、2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO和2NaCl+2H2O=2NaOH+H2↑+Cl2↑可得如下关系式:6CH3OH→6CO→7Cl2→7H2,而6CH3OH→12H2,故每生产6molCH3OH(192g)需额外补充5molH2(10g),则生产192t甲醇,至少需额外补充10t氢气。
点评:该题是高考中的常见题型,难度大,综合性强,对学生的要求高。试题在注重对基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力,提升学生的学科素养。该类试题要求学生能够具备通过对自然界、生产、生活和科学实验中化学现象以及相关模型、图形和图表等的观察,获取有关的感性知识和印象,并运用分析、比较、概括、归纳等方法对所获取的信息进行初步加工和应用的能力;能够敏捷、准确地获取试题所给的相关信息,并与已有知识整合,在分析评价的基础上应用新信息的能力。
本题难度:一般
5、选择题 对于以下反应:A(s)+3B(g)? ?2C(g)+D(g),在一定温度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时就可确定反应一定达到平衡状态的是 ?2C(g)+D(g),在一定温度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时就可确定反应一定达到平衡状态的是
A.容器的体积不再发生变化
B.B的生成速率和D的反应速率之比为3∶1
C.混合气体的密度不随时间变化
D.B、C、D的分子个数之比为3∶2∶1
参考答案:C
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。根据方程式可知,反应前后体积是不变的,所以A不正确。B中中反应速率的方向是相同的,不正确。密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但气体的质量变化的,所以C可以说明。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此选项D不正确,所以答案选C。
本题难度:简单
|