微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下表为长式周期表的一部分,其中的编号代表对应的元素。
①
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ②
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ③
| ?
| ?
| ?
| ?
|
?
| ④
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ⑤
| ?
| ?
| ⑥
| ⑦
| ?
|
?
| ⑧
| ?
| ?
| ?
| ?
| ?
| ⑨
| ?
| ?
| ⑩
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
请回答下列问题:
(1)表中属于d区的元素是??????????(填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为?????;
(3)④ ⑤ ⑥ ⑦四种元素的第一电离能由大到小的顺序是??????????(用元素符号表示)。
(4)按原子轨道的重叠方式,③与⑥形成的化合物中σ键有?????个,π键有?????个。
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为??????;该元素与元素①形成的分子X的空间构形为??????????,属于???????分子(填“极性”或“非极性”)。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:?????????????????。
(7)1183 K以下⑨元素形成的晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的原子间距离相同。
 ???????
???????
在1183 K以下的晶体中,与⑨原子等距离且最近的⑨原子数为______个,在1183 K以上的晶体中,与⑨原子等距离且最近的⑨原子数为________。
参考答案:(每空1分,共,11分)(1)⑨??(2)苯 (3)Cl&g
本题解析:
试题分析:(1)区的名称来自于按照构造原理最后填入电子的轨道名称,属于表中属于d区的元素是⑨。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子是苯。
(3)④ ⑤ ⑥ ⑦四种元素分别是Mg、Al、S、Cl。金属性越强第一电离能越大。但由于镁元素的3s轨道电子处于全充满状态,所以第一电离能对于Al元素的,则第一电离能由大到小的顺序是Cl> S> Mg> Al。
(4)按原子轨道的重叠方式,③与⑥形成的化合物是二硫化碳,分子中含有2个双键。而双键是由
本题难度:困难
2、填空题 按要求书写电子式。
a.原子电子式的书写:H____;Mg____;Al______; C______;N____;O____; F____;Ne_____;
b.简单阳离子电子式的书写:钠离子______;镁离子______;铝离子______;氢离子______;
c.简单阴离子电子式的书写:硫离子______;氯离子______;氧离子______; 氢负离子______;
d.离子化合物的电子式书写:MgO_______,Na2S_______ K2S:_______;CaF2_______;
e.用电子式表示离子键的形成过程:KBr_______;MgCl2_______;K2O_______
参考答案:a.![]() 本题解析:
本题解析:
本题难度:一般
3、选择题 甲、乙、丙、丁四种元素位于同一短周期,原子序数依次增加.已知:甲最外层电子数最少,丁氢化物水溶液是一种常见强酸,丙的最外层电子数是最内层电子数的两倍,下列判断正确的是( )
A.原子半径:甲<乙
B.最外层电子数:乙>丙
C.电解甲和丁形成化合物的水溶液可获得甲单质
D.丙的氧化物溶于甲的氧化物的水化物
参考答案:甲、乙、丙、丁四种元素位于同一短周期,原子序数依次增加,丙的
本题解析:
本题难度:简单
4、填空题 A、B、C、D、E、F六种元素的原子序数依次增大。A的最高正价和最低负价的绝对值相等。B的基态原子有3个不同的能级且各能级中电子数相等。D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)F的基态原了价电子排布式为???????。
(2)B、C、D、E的原子的第一电离能由小到大的顺序为???。(用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是
A.分子中都含有σ键和π键
B.中心原子都sp杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有????????????。
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示。B位于E和F原子紧密堆积所形成的空隙当中。与一个F原子距离最近的F原子的数目为???????,该晶体的化学式为????????????。若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,,则该晶体的密度表达式为???????g·cm3。
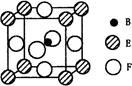
参考答案:(1)3d84s2
(2)Mg? C? O? N
本题解析:
试题分析:根据题意可知这这几种元素分别是:A:H元素;B:C元素;C:N元素;D:O元素;E:Mg元素;F:Ni元素。(1)Ni的基态原了价电子排布式为3d84s2。(2)元素的非金属性越强,其越容易失去电子,电离能就越小。非金属性Mg < C < O < N ,所以它们的第一电离能由小到大的顺序为Mg < C < O < N。(3)在C2H2中 每个C原子采用sp杂化,与H原子形成1个σ键,与另一个C原子形成1个σ键和2个π键,而在H2O2中,每个O原子采用s
本题难度:一般
5、选择题 某元素R的气态氢化物化学式为H2R,则R的最高价氧化物对应水化物的化学式是[???? ]
A.HRO3
B.H2RO3
C.H2RO4
D.H3RO4
参考答案:C
本题解析:
本题难度:简单