微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在下列各说法中,正确的是
A.ΔH>0表示放热反应,ΔH<0表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
参考答案:B
本题解析:A项,ΔH>0表示吸热反应,ΔH<0表示放热反应;C项,“中和热”是指在稀溶液中,酸和碱发生中和反应,生成1 mol水时放出的热量,1 mol H2SO4与1 mol Ba(OH)2反应生成2 mol水,放出的热大于中和热;D项,在101 kPa时,1 mol H2与0.5 mol O2反应,生成液态水时放出的热才是H2的燃烧热,题中没有说明生成的水的聚集状态。
本题难度:一般
2、填空题 2002年诺贝尔化学奖的一半奖金授予了瑞士科学家库尔特 维特里希,以表彰他发明了利用核磁共振技术测定溶液中生 物大分子三维结构的方法。核磁共振技术是利用核磁共振谱 来测定有机化合物结构,最有实用价值的就是氢谱,常用HNMR 表示,如:乙醚( CH3CH2OCH2CH3)分子中有两种氢原子,其HNMR谱中有两个共振峰,两个共振峰的面积比为3:2,而 乙醇分子中有三种氢,HNMR谱中有三个共振峰,三个共振峰之间的面积比为3:2:1。
(1)请写出分子式C4H8在HNMR谱中两个共振峰面积比为 3:1的化合物的结构简式________。
(2)C4H10的HNMR谱有两种,其中作打火机的液体燃料的C4H10的HNMR谱的两个共振峰的面积比为____,结构简式为____;其同分异构体的两个共振峰的面积比为 ____,结构简式为____。
参考答案:(1) CH3CH=CHCH3、CH2=C(CH3)2
本题解析:
本题难度:一般
3、选择题 现有一瓶甲和乙的混合物,已知甲和乙的某些性质如下表:
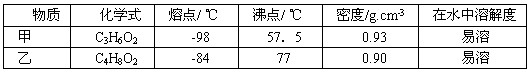
据此,将甲和乙互相分离的最佳方法是
A.萃取法
B.蒸发法
C.蒸馏法
D.分液法
参考答案:C
本题解析:考查物质的分离和提纯。根据甲和乙的性质可知,只有二者的沸点相差较大,所以分离二者应该采用蒸发,答案选C。
本题难度:一般
4、选择题 体积为1L干燥容器中充入HCl气体后,测得容器中气体对氧气的相对密度为1.082.将此气体倒扣在水中,进入容器中液体的体积是
A.0.25L
B.0.5L
C.0.75L
D.1L
参考答案:C
本题解析:分析:容器中的气体相对氧气的密度为1.082,则气体的平均相对分子质量为1.082×32=34.6,令HCl的体积分数为x,则空气的体积分数为(1-x),根据平均相对分子质量计算x的值,进而计算HCl的体积,HCl的体积即为进入容器中液体的体积.
解答:容器中的气体相对氧气的密度为1.082,则气体的平均相对分子质量为1.082×32=34.6,
令HCl的体积分数为x,则空气的体积分数为(1-x),则:
36.5x+29(1-x)=34.6,
解得:x=0.75
故HCl的体积为1L×0.75=0.75L,
即为进入容器中液体的体积0.75L,
故选C.
点评:本题考查阿伏伽德罗定律及推论、化学计算等,难度中等,根据平均相对分子质量计算HCl的体积分数是关键.
本题难度:一般
5、选择题 用NA?表示阿伏加德罗常数的数值,下列说法中正确的是
A.在常温常压下,11.2?L氯气所含的原子数目为NA
B.32?g臭氧含的原子数目为2NA
C.5.6?g铁与足量盐酸反应转移的电子数为0.3NA
D.16g?CH4与18?g?NH4+?所含电子数不相等
参考答案:B
本题解析:分析:A、常温常压下,气体摩尔体积不是22.4L/mol;
B、臭氧分子由氧原子构成,根据n=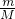 计算氧原子的物质的量,再根据N=nNA计算氧原子数目;
计算氧原子的物质的量,再根据N=nNA计算氧原子数目;
C、根据n=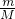 计算5.6?g铁的物质的量,铁与盐酸反应生成氯化亚铁,反应中铁原子失去2个电子形成亚铁离子,转移电子物质的量为铁的2倍,再根据N=nNA计算转移电子数目;
计算5.6?g铁的物质的量,铁与盐酸反应生成氯化亚铁,反应中铁原子失去2个电子形成亚铁离子,转移电子物质的量为铁的2倍,再根据N=nNA计算转移电子数目;
D、根据n=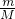 计算16g?CH4与18?g?NH4+?的物质的量,CH4与NH4+都含有10个电子,据此判断.
计算16g?CH4与18?g?NH4+?的物质的量,CH4与NH4+都含有10个电子,据此判断.
解答:A、常温常压下,气体摩尔体积不是22.4L/mol,11.2?L氯气的物质的量不是0.5mol,所含的原子数目不是NA,故A错误;
B、臭氧分子由氧原子构成,氧原子的物质的量为 =2mol,氧原子数目为2mol×NAmol-1=2NA,故B正确;
=2mol,氧原子数目为2mol×NAmol-1=2NA,故B正确;
C、5.6?g铁的物质的量为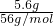 =0.1mol,铁与盐酸反应生成氯化亚铁,反应中铁原子失去2个电子形成亚铁离子,转移电子物质的量为铁的2倍,转移电子数目为0.1mol×2×NAmol-1=0.2NA,故C错误;
=0.1mol,铁与盐酸反应生成氯化亚铁,反应中铁原子失去2个电子形成亚铁离子,转移电子物质的量为铁的2倍,转移电子数目为0.1mol×2×NAmol-1=0.2NA,故C错误;
D、16g?CH4的物质的量为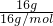 =1mol,18?g?NH4+?的物质的量为
=1mol,18?g?NH4+?的物质的量为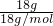 =1mol,CH4与NH4+都含有10个电子,二者物质的量相同,含有电子数目相同,故D错误;
=1mol,CH4与NH4+都含有10个电子,二者物质的量相同,含有电子数目相同,故D错误;
故选B.
点评:考查常用化学计量的有关计算,难度不大,注意A选项中气体摩尔体积的使用条件与对象.
本题难度:简单