微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某些金属卤化物可跟其卤素反应,如KI+I2?KI3下列推断错误的是
A.溶液中存在如下平衡:?
B.在KI3溶液中加入AgNO3溶液,会析出AgI3沉淀
C.KI3溶液可用于检验淀粉的存在
D.配制碘水时,加入KI可增大I2的溶解度
参考答案:B
本题解析:分析:根据KI+I2?KI3可知,在KI3溶液中存在I3-、I-、I2等粒子,结合对应的物质的性质以及平衡移动的影响因素解答该题.
解答:A.由反应KI+I2?KI3可知,溶液中存在平衡I3-?I-+I2,故A正确;
B.在KI3溶液中存在I-,加入AgNO3溶液,会析出AgI沉淀,故B错误;
C.在KI3溶液中存在I2,可用于检验淀粉的存在,故C正确;
D.从平衡移动的角度分析,对于平衡I3-?I-+I2,增加I-浓度,平衡向生成I3-的方向移动,可增大I2的溶解度,故D正确.
故选B.
点评:本题考查氯溴碘及其化合物的综合应用,题目难度中等,本题注意根据可逆反应的特点解答该题.
本题难度:一般
2、选择题 对下列物质:①纯碱②食盐水③浓硫酸④烧碱?⑤液态氧⑥氯酸钾,分类全部正确的是
A.碱--①④
B.纯净物--③④⑤
C.混合物--②⑤
D.盐--①⑥
参考答案:D
本题解析:分析:①纯碱为碳酸钠,是由金属离子和酸根离子构成的,则属于盐类化合物;
②食盐水是由食盐和水两种物质组成,则属于混合物;
③浓硫酸中含硫酸和水,属于混合物;
④烧碱为氢氧化钠,在水中电离的阴离子全部为OH-,则属于碱;
⑤液态氧是一种只有氧元素组成的物质,则属于单质;
⑥氯酸钾是由金属离子和酸根离子构成的,则属于盐类化合物.
解答:A.碱--①④不正确,因①纯碱为碳酸钠,是由金属离子和酸根离子构成的,则属于盐类化合物,故A错误;
B.纯净物--③④⑤不正确,因③浓硫酸中含硫酸和水,属于混合物,故B错误;
C.混合物--②⑤不正确,因⑤液态氧是一种只有氧元素组成的物质,则属于单质,故C错误;
D.盐--①⑥正确,因①纯碱和⑥氯酸钾都是由金属离子和酸根离子构成的,则属于盐类化合物,故D正确.
故选D.
点评:本题考查纯净物、混合物,酸碱盐的定义等,难度不大,注意概念之间的区别和联系.
本题难度:困难
3、选择题 由镁、铝、铁三种金属单质中的两种组成的混合物共6g,与足量的稀盐酸反应,产生标准状况下的氢气2.8L,由此得出的结论中正确的是
A.混合物中一定含有铝
B.混合物中一定含有铁
C.该混合物一定是由铁和镁组成的
D.混合物中一定不含有铁
参考答案:B
本题解析:分析:根据n= 计算氢气的体积,根据电子转移守恒计算提供1mol电子需要金属的平均质量,计算提供1mol电子需要各金属的质量,根据平均值判断.
计算氢气的体积,根据电子转移守恒计算提供1mol电子需要金属的平均质量,计算提供1mol电子需要各金属的质量,根据平均值判断.
解答:标准状况下,2.8L氢气的物质的量= =0.125mol,
=0.125mol,
根据电子转移守恒可知,6g混合金属提供电子的物质的量为0.125mol×2=0.25mol,
故提供1mol电子需要混合金属的平均质量为6g× =24g,
=24g,
镁与盐酸反应表现+2价,提供1mol电子需要Mg的质量为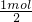 ×24g/mol=12g,
×24g/mol=12g,
铝与盐酸反应表现+3价,提供1mol电子需要Al的质量为 ×27g/mol=9g,
×27g/mol=9g,
铁与盐酸反应表现+2价,提供1mol电子需要Fe的质量为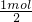 ×56g/mol=28g,
×56g/mol=28g,
Fe提供1mol电子的质量大于24g,Mg、Al提供1mol电子的质量小于24g,故一定含有Fe,Mg、Al至少含有一种,
故选B.
点评:本题考查混合物的有关计算,难度不大,注意利用平均值法与极限法的利用.
本题难度:困难
4、选择题 下列离子方程式与所述事实相符且正确的是
A.H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑
B.用双氧水和稀硫酸处理铜板:Cu+H2O2+2H+=Cu2++2H2O
C.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
D.铵明矾[AlNH4(SO4)2?12H2O]溶液中加入过量氢氧化钡溶液:Al3++NH4++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3?H2O+2H2O
参考答案:BD
本题解析:分析:A.发生氧化还原反应生成NaOH和氧气,水既不是氧化剂也不是还原剂;
B.发生氧化还原反应生成硫酸铜和水;
C.反应生成碳酸钙和HClO;
D.[AlNH4(SO4)2?12H2O]完全反应.
解答:A.H218O中投入Na2O2固体的离子反应为2H218O+2Na2O2=418OH-+O2↑4Na+,故A错误;
B.用双氧水和稀硫酸处理铜板的离子反应为Cu+H2O2+2H+=Cu2++2H2O,故B正确;
C.漂白粉溶液在空气中失效的离子反应为Ca2++2ClO-+CO2+H2O=2HClO+CaCO3↓,故C错误;
D.铵明矾[AlNH4(SO4)2?12H2O]溶液中加入过量氢氧化钡溶液的离子反应为Al3++NH4++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3?H2O+2H2O,故D正确;
故选BD.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意反应的实质,选项A中的氧化还原及D中与量有关的离子反应为解答的难点,题目难度中等.
本题难度:一般
5、选择题 下列反应中不能引入羟基(—OH)的是
A.加成反应
B.取代反应
C.消去反应
D.还原反应
参考答案:C
本题解析:乙烯和水加成引入羟基,溴苯和氢氧化钠的水溶液反应取代生成苯酚,乙醛加氢生成乙醇,消去反应减去羟基。
本题难度:简单