微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在元素周期表中金属元素和非金属元素的分界线附近的一些元素能用于制
[???? ]
A.合金
B.半导体
C.催化剂
D.农药
参考答案:B
本题解析:
本题难度:简单
2、选择题 甲和乙都属于非金属元素,下列叙述中,不能说明甲原子得电子能力比乙强的是( )
A.甲比乙容易与氢气化合
B.甲单质能与乙的阴离子在水溶液中发生氧化还原反应
C.最高价氧化物对应的水化物的酸性甲强于乙
D.与某金属反应时,甲原子得电子数目比乙原子多
参考答案:A.甲比乙容易与氢气化合,则甲得电子的能力强,故A正确;
本题解析:
本题难度:简单
3、选择题 已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
[???? ]
A.化合物BmAm分子中所有原子一定共平面
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
C.工业上常用电解法制备元素C、D、E的单质
D.化合物AE与CE具有相同类型的化学键
参考答案:BC
本题解析:
本题难度:一般
4、简答题 下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族
周期 | IA | | 0
1
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
②
③
④
3
⑤
⑥
⑦
⑧
(1)④、⑤、⑥的原子半径由大到小的顺序为______(用元素符号表示).
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是______.
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式:______.
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)______.
a.MnO2 b.AlCl3 c.Na2SO3???? d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
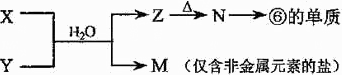
X溶液与Y溶液反应的离子方程式为______,N→⑥的单质的化学方程式为______.
(6)已知破坏1mol??N≡N键、H-H键、N-H键分别需要吸收的能量为946kJ、436kJ、391kJ.则1molN2完全反应转化为NH3共______(填“吸收”或“放出”)能量______?kJ.
参考答案:根据元素在周期表中的位置可判断元素的种类,①为H元素,②为C
本题解析:
本题难度:一般
5、填空题 下图是元素周期表中的一部分.
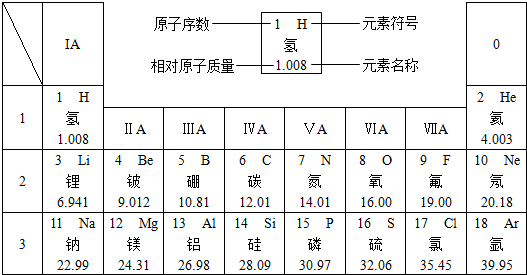
在元素周期表中,同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强.
请回答:
(1)硅的相对原子质量为______;原子序数为8的元素位于元素周期表的第______周期,元素符号为______,它属于______(填“金属”或“非金属”)元素.
(2)原子半径:钠______镁(填“>”或“=”或“<”,下同),原子得电子能力:硫______氯.
参考答案:(1)元素周期表中,元素符号下方的数字代表元素的相对原子质量
本题解析:
本题难度:简单
|