微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (17分)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g)? K1???H < 0?(I)
NaNO3(s)+ClNO(g)? K1???H < 0?(I)
2NO(g)+Cl2(g) 2ClNO(g)?????????????? K2???H < 0?(II)
2ClNO(g)?????????????? K2???H < 0?(II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=?????????(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=?????????(用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)=??????????mol,NO的转化率а1=???????。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2????????а1(填“>”“<”或“=”),平衡常数K2???????????(填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是?????????????????????????????。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol?L?1的CH3COONa溶液,则两溶液中c(NO3?)、c(NO2-)和c(CH3COO?)由大到小的顺序为???????????????????。(已知HNO2的电离常数Ka=7.1×10-4mol?L?1,CH3COOH的电离常数K a=1.7×10-5mol?L?1,可使溶液A和溶液B的pH相等的方法是?????????????。
a.向溶液A中加适量水?????? b.向溶液A中加适量NaOH
c.向溶液B中加适量水?????? d.向溶液B中加适量NaOH
参考答案:(1)K12/ K2
(2)2.5×10-2;75%;
本题解析:
试题分析:(1)设已知的两个反应为①②,则4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)可由2×①—②,则K= K12/ K2
2NaNO3(s)+2NO(g)+Cl2(g)可由2×①—②,则K= K12/ K2
(2)转化的n(Cl2)=1/2×7.5×10-3mol?L-1?min-1×2L×10min=7.5×10-2,则平衡后n(Cl2)=0
本题难度:一般
2、选择题 足量的金属铁与下列酸溶液反应,初始反应速率最快且最终产生氢气最多的是
A.100mL0.1mol/L盐酸
B.100mL0.2mol/L硝酸
C.75 mL0.2mol/L盐酸
D.20mL18.4mol/L硫酸
参考答案:C
本题解析:B、D中的酸为强氧化性酸,与铁不会产生氢气,而A、C相比,C中氢离子的浓度较大,故产生氢气的速率最大。
本题难度:一般
3、选择题 对于反应M+N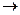 P如果温度每升高
P如果温度每升高 10℃,反应速率增加为原来的3倍。在10℃时完成反应的10%需要54min,将温度提高到400C完成反应的10%需要的时间为
10℃,反应速率增加为原来的3倍。在10℃时完成反应的10%需要54min,将温度提高到400C完成反应的10%需要的时间为
A.2min
B.3min
C.6min
D.9min
参考答案:A
本题解析:略
本题难度:简单
4、计算题 (1)将不同量的CO(g)和H2O(g)分别通入体积2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
实验组
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
CO
| H2O
| H2
| CO
|
1
| 650
| 4
| 2
| 1.6
| 2.4
| 6
|
2
| 900
| 2
| 1
| 0.4
| 1.6
| 3
?
①实验1中以v(CO2)表示的平均反应速率为????????(第二位小数)。
②该反应为??????(填“吸热”或“放热”)反应。
③求实验2的平常常数K,要求写出计算过程,结果取二位小数。
(2)已知在常温常压下:
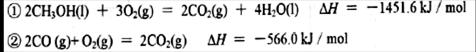
写出甲醇不完全燃烧生成CO和液态水的热化学方程式?????????????????????????。
(3)甲醇和氧气完全燃烧的反应可以设计为燃料电池,装置如图,该电池通过K2CO3溶液吸收反应生的CO2。则负极的电极反应为??????????????。

(4)CaCO3的KSP=2.8×10?9。将等体积CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10?4mol/L,则生成沉淀所需该CaCl2溶液的最小浓度为????????。
参考答案:(16分)
(1) ①0.13mol/(L·min)?
本题解析:
试题分析:(1)①由于v=△c/△t=△n/(V?△t),生成物的起始量为0,则可先求v(H2)=1.6mol÷2L÷6min=0.4/3mol/(L?min),根据化学方程式中系数之比等于速率之比,则v(CO2)= v(H2)= 0.4/3mol/(L?min)≈0.13mol/(L?min);②③根据表中数据,实验1中:
CO(g)+H2O(g) 
本题难度:一般
5、选择题 对可逆反应4NH3(g) + 5O2(g) 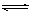 ?4NO(g) + 6H2O(g),下列叙述正确的是 ?4NO(g) + 6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减小,平衡正向移动
D.化学反应速率关系是:2v正(NH3)= 3v正(H2O)
参考答案:A
本题解析:
试题分析:A、4v正(O2)=5v逆(NO),不同物质表示正逆反应速率之比等于化学计量数之比,表示反应达到平衡状态,故A正确;B、若单位时间内生成xmolNO的同时,消耗xmolNH3,都表示向反应正向进行,反应自始至终都是1:1,不能说明到达平衡,故B错误;C、达到化学平衡时,若增加容器体积,则物质的浓度减小,正逆反应速率均减小,平衡向正反应移动,故C错误;D、化学反应速率关系是:3υ正(NH3)=2υ正(H2O),故D错误.故选A.
本题难度:一般
|