微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式的书写正确的是
A.铁与FeCl3溶液反应:Fe +Fe3+="=2" Fe2+
B.小苏打与氢氧化钠溶液混合:HCO3-+ OH-="=" CO2↑ + H2O
C.金属铝加入到NaOH溶液中: Al+2OH-+H2O====AlO2-+2H2↑
D.钠与水的反应 2Na + 2H2O ===2Na+ +2OH- + H2↑
参考答案:D
本题解析:
试题分析:A项电荷没有配平,错;小苏打与氢氧化钠溶液反应不能产生CO2,产物错误,B错;C项电荷没有配平,C错;D对。
考点:离子方程式的判断。
本题难度:一般
2、填空题 按要求写出下列方程式
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式是:
(2)已知在25℃、101kPa时,CO的燃烧热为283kJ/mol,相同条件下,若2molCH4完全燃烧生成液态水,所放出的热量为1molCO完全燃烧放出热量的6.3倍,CH4完全燃烧反应的热化学方程式是:
(3)Al(OH)3的电离反应方程式:
(4)H2S的电离反应方程式:
(5)NaHSO4溶于水的电离方程式
参考答案:(1)CH3OH(l)+ O2(g)→CO2(g)+2H2O
本题解析:
试题分析:(1)热化学方程式中化学计量数表示物质的量。(2)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量。(3)氢氧化铝是两性氢氧化物,有酸式电离和碱式电离。(4)多元弱酸分步电离。(5)NaHSO4是强电解质,水溶液中完全电离出Na+、H+、SO42-。
考点:热化学方程式的书写 电离方程式的书写 燃烧热
点评:多元弱酸分步电离、多元弱碱一步电离,书写电离方程式时用“ ”。
”。
本题难度:一般
3、选择题 有失去标签的A、B、C、D四瓶溶液,它们的成分可能是Na2CO3、K2SO4、Ba(NO3)2、NaHSO4中的某一种,进行下列实验:
(1)A+C→溶液①+气体① (2)B+A→溶液②+沉淀①
(3)C+B→溶液③+沉淀② (4)溶液③+沉淀①→溶液④+气体①
根据上述实验结果,写出上述过程的离子方程式:
(1) 。
(2) 。
(3) 。
(4) 。
参考答案:(1)2H++CO32— =CO2↑+H2O &#
本题解析:
试题分析:B与A、C混合都有沉淀析出,因此B应为Ba(NO3)2。A和C混合有气体生成,这说明二者应该是碳酸钠和硫酸氢钠,则D是硫酸钾。将沉淀①与溶液③混合,沉淀溶解并产生气味,这说明该沉淀一定是碳酸钡,所以A是碳酸钠,则C是硫酸氢钠。因此反应中的有关离子反应方程式分别是2H++CO32— =CO2↑+H2O、CO32—+ Ba2+ =BaCO3↓、Ba2++SO42— =BaSO4↓、BaCO3+2H+ =Ba2+ +CO2↑+H2O。
考点:考查物质推断以及离子方程式的书写
本题难度:一般
4、选择题 下列化学反应的离子方程式书写不正确的是
A.碳酸钙与盐酸的反应: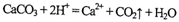
B.等物质的量的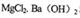 和HCl溶液混合:
和HCl溶液混合: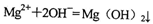
C.氧化铜与稀H2SO4反应: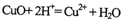
D.金属钠跟水反应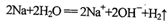
参考答案:B
本题解析:
试题分析:等物质的量的氯化镁和氢氧化钡与盐酸混合,酸先中和碱,在碱性环境中镁才生成白色沉淀,先有H++OH-=H2O,可能有Mg2++2OH-=Mg(OH)2,其余符合离子方程式的书写,选B。
考点:考查离子方程式的正误判断。
本题难度:一般
5、选择题 向含有一定量盐酸和少量MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生沉淀的质量m克与加入Ba(OH)2的物质的量n之间的关系如图所示,下列说法正确的是

A.a b时的沉淀成分为BaSO4与Mg (OH) 2
b时的沉淀成分为BaSO4与Mg (OH) 2
B.原混合溶液中:n(HCl)=2mol
C.c点时的溶液中c (Cl-)>c(OH-)>c(Ba2+)
D.b c时发生的离子反应为H++OH-=H2O
c时发生的离子反应为H++OH-=H2O
参考答案:D
本题解析:
试题分析:向含有一定量盐酸和少量MgSO4的混合溶液中逐滴加入Ba(OH) 2溶液,的a b,发生反应:H++OH-=H2O;Ba2++SO42-=BaSO4↓;所以a
b,发生反应:H++OH-=H2O;Ba2++SO42-=BaSO4↓;所以a b时的沉淀成分为BaSO4,选项A错误;在b
b时的沉淀成分为BaSO4,选项A错误;在b c时发生的离子反应为H++OH-=H2O,选项D正确.所以沉淀的质量不变;由于当盐酸反应完全时消耗Ba(OH)2的物质的量是2mol,则根据方程式H++OH-=H2O可知盐酸的物质的量是4mol;所以选项B错误;在c
c时发生的离子反应为H++OH-=H2O,选项D正确.所以沉淀的质量不变;由于当盐酸反应完全时消耗Ba(OH)2的物质的量是2mol,则根据方程式H++OH-=H2O可知盐酸的物质的量是4mol;所以选项B错误;在c d时发生的离子反应为Mg2++ 2OH-= Mg(OH)2↓,此后再加入氢氧化钡,也不能写成沉淀,沉淀的物质的量也不再减小。在b点时SO42-沉淀完全,消耗Ba2+1mol,在加入Ba(OH)2的物质的量是2mol的溶液的C点,含有n(Ba2+)=1mol,含有n(Cl-)=4mol,溶液中含有MgCl2,不可能含有大量的OH-;所以溶液中离子浓度关系是:c (Cl-)>c(Ba2+)>c(OH-),选项C错误,
d时发生的离子反应为Mg2++ 2OH-= Mg(OH)2↓,此后再加入氢氧化钡,也不能写成沉淀,沉淀的物质的量也不再减小。在b点时SO42-沉淀完全,消耗Ba2+1mol,在加入Ba(OH)2的物质的量是2mol的溶液的C点,含有n(Ba2+)=1mol,含有n(Cl-)=4mol,溶液中含有MgCl2,不可能含有大量的OH-;所以溶液中离子浓度关系是:c (Cl-)>c(Ba2+)>c(OH-),选项C错误,
考点:考查溶液中离子浓度大小比较、反应的先后顺序的知识。
本题难度:一般