微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 设计一个实验方案,使如图所示装置中的铁棒上析出铜,而铁的质量不变(可用文字叙述,也可用图示意)。
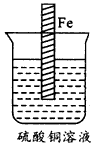
参考答案:方法一:在溶液中再放一锌片,并用导线将锌片与铁片相连,就能达
本题解析:
本题难度:一般
2、实验题 乙醛能与银氨溶液反应析出银。如果条件控制适当,析出的银会均匀地分布在试管壁上,形成光亮的银镜,这个反应又叫银镜反应。银镜的光亮程度与反应条件有关。某课外活动小组同学在课外活动中对乙醛的银镜反应进行了探究。
Ⅰ. 探究银镜反应的最佳实验条件部分实验数据如下表:
??实验变量
实验序号
| 银氨溶液
/mL
| 乙醛的量
/滴
| 水液温度/℃
| 反应混合液的PH
| 出现银镜时间/min
|
1
| 1
| 3
| 65
| 11
| 5
|
2
| 1
| 3
| 45
| 11
| 6.5
|
3
| 1
| 5
| 65
| 11
| 4
|
4
| 1
| 3
| 30
| 11
| 9
|
5
| 1
| 3
| 50
| 11
| 6
|
6
| 1
| 5
| 80
| 11
| 3
?
请回答下列问题:
(1)读表若只进行实验1和实验3,其探究目的是????????????????????????????。
(2)推理当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为40℃,反应混合液pH为11时,出现银镜的时间是???????;要探索不同水浴温度下乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成的银镜的???????????????????。
(3)进一步实验?若还要探索银氨溶液的用量对出现银镜快慢的影响,如何进行实验?
?????????????????????????????????????????????????????????????????????????。
Ⅱ. 探究对废液的回收处理:
银氨溶液放久后会变成氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。通过查找资料,已知从银氨溶液中提取银的一种实验流程为:

操作④的方法是:把Ag2S和铁粉放到烧杯中加浓盐酸搅拌煮沸,使Ag2S变成银粉。反应的化学方程式为:Ag2S+Fe+2HCl 2 Ag+ FeCl2+H2S↑。 2 Ag+ FeCl2+H2S↑。
(4)若获得的银粉中含有少量没有反应完的铁粉,除去铁的反应的离子方程式为:?????????????????????????????????,需要用到的玻璃仪器有???????????(填编号)。

a????? b??????? c?????? d??????? e????? f??????? g
(5)操作④应在(填实验室设备名称)??????????????中进行。
(6)要洗去试管壁上的银镜,采用的试剂是??????????????(填名称)。
参考答案:(17分)
(1)比较乙醛用量不同时生成银镜的时间(速
本题解析:
试题分析:(1)依题意,对比表中实验1和3,二者使用乙醛的量分别是3滴、5滴,其它条件保持不变,出现银镜时间分别为5min、4min,说明这组实验探究的目的是比较乙醛用量不同时生成银镜的时间(速度或质量);(2)依题意,实验4、2、5的探究目的是比较不同温度时生成银镜的时间(速度或质量),30℃、45℃、50℃出现银镜的时间分别为9min、6.5min、6min,由于30℃<40℃<45℃,则40℃出现银镜的时间应该介于30℃、45℃出现银镜的时间之间,即在6.5min ~9min之间;出现银镜的时间表示化学反应速率的快慢,最佳反应条件还应包括形成的银镜的光亮程度或亮度、外观、效果等;(3)根据控制变量设计实验方案的原则,应保持其他的实验条件不变,改变银氨溶液的用量,测量生成银镜的时间,以探究银氨溶液的用量对出现银镜快慢的影响;(4)由金属活动性顺序表可知,Fe>H2>Ag,则铁粉与非氧化性酸能发生置换反应,生成亚铁盐溶液、放出氢气,而银不溶于非氧化性,因此选择过量的稀盐酸除去银粉中混有的少量铁粉,即Fe+2H+=Fe2++H2↑,充分反应后过滤、洗涤得到的沉淀就是不含铁的银;溶解、过滤常常需要使用的仪器是烧杯、漏斗、玻璃棒,故bef正确;(5)铁粉还原硫化银时,由于Ag2S+Fe+2HCl 2 Ag+ FeCl2+H2S↑,反应放出的硫化氢气体有毒,因此该过程需要在通风橱中进行,多余的尾气需要用废碱液吸收处理,不能直接排入空气,以免污染环境;(6)银不溶于非氧化酸,实验室常用稀硝酸或浓硝酸氧化银,即3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O或Ag+2HNO3(浓)=AgNO3+NO2↑+H2O。 2 Ag+ FeCl2+H2S↑,反应放出的硫化氢气体有毒,因此该过程需要在通风橱中进行,多余的尾气需要用废碱液吸收处理,不能直接排入空气,以免污染环境;(6)银不溶于非氧化酸,实验室常用稀硝酸或浓硝酸氧化银,即3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O或Ag+2HNO3(浓)=AgNO3+NO2↑+H2O。
本题难度:一般
3、实验题 某化学兴趣小组同学进行如下实验。
(1)使用铜和稀硫酸制备硫酸铜晶体。步骤如下

步骤①观察到的现象是:______________________。
步骤③的主要操作包括:______________________。
(2)某同学查资料知:铜与稀硫酸不反应,若在稀硫酸中加入H2O2,铜可逐渐溶解。实验装置如图,写出该反应的化学方程式_____________________________
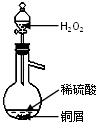
(3)?铜粉放入稀硫酸中,加热后无明显现象发生。当加入一种物质后,铜粉开始溶解,溶液变蓝色,同时有气体逸出,该物质是__________(填字母); ?????
A.Al2(SO4)3????????B.Na2CO3??? C.KNO3???????????D.FeSO4 ????
写出该反应的离子方程式_______________________。
参考答案:(1)红色固体变黑;?加热浓缩,冷却结晶,过滤
(2)
本题解析:
本题难度:一般
4、实验题 (共12分)I.(6分)常压下乙醇的沸点为78.5℃,乙酸的沸点为118℃,以下是分离乙醇、乙酸的方案,请填空[(1)(3)是药品,(2)(4)是操作名称]

填空:(1)???????????????(3)???????????????(4)????????????
MnO2
?
II.(6分)下图装置是用燃烧法来确定有机物组成的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成(已知:C中的氧化铜是确保有机物中的碳元素完全转化为二氧化碳;A中的反应为2H2O2 = 2H2O + O2↑)。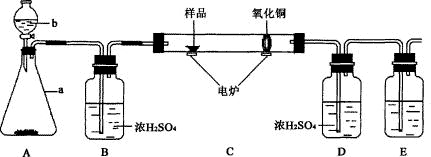
回答下列问题:
(1)A装置中a仪器的名称________,b中盛放的物质是________(填化学式)。
(2)若去掉B装置会对什么元素的测量结果有影响??????????(填元素符号)
(3)E装置中所盛放物质最好选用________(选填:①氢氧化钙溶液?②氢氧化钠溶液 ③水)
(4)若准确称取1.12g样品(样品只含C、H、O三种元素中的两种或三种)。经充分?燃烧后,D装置增重1.44g,E装置增重3.52g,则该有机物样品中所含的元素为________(填元素符号)。
参考答案:(共12分)I.(6分每空2分)(1)氧化钙或氢氧化钠填化学
本题解析:略
本题难度:一般
5、实验题 现拟用图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量

(1)制备一氧化碳的化学方程式是 ?????????????????? ;
(2)试验中,观察到反应管中发生的现象是 ??????????????? ;尾气的主要成分是 ???????? ;
(3)反应完成后,正确的操作顺序为 ??????????? (填字母)
a.关闭漏斗开关? b.熄灭酒精1?? c.熄灭酒精灯2
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为 ????????? ;
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节) ?????????????????????????????????? ;
②写出有关反应的化学方程式 ????????????????? .
参考答案:(1)HCOOH 本题解析:(1)甲酸在浓硫酸、加热的条件下分解生成CO与H2O; 本题解析:(1)甲酸在浓硫酸、加热的条件下分解生成CO与H2O;
(2)实验中,反应管中发生反应CuO+CO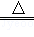 Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2; Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;
(3)实验步骤:先通入CO一会儿后,加热待反应管内的药品完全后,停止加热,然后继续通入CO到玻璃管冷却为止;
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,剩余固体全部为铜,利用差量法计算出原样品中氧化铜的质量,进而计算铜的质量分数;
(5)①要测定铜的质量分数,可以把浓硫酸稀释,铜和稀硫酸不反应,氧化铜和稀硫酸反应,即可求出铜的质量分数.设计方案的主要步骤是将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可.②反应的化学方程式为CuO+H2SO4=CuSO4+H2O.
解:(1)甲酸在浓硫酸、加热的条件下分解生成CO与H2O,反应方程式为HCOOH CO↑+H2O; CO↑+H2O;
故答案为:HCOOH CO↑+H2O; CO↑+H2O;
(2)实验中,反应管中发生反应CuO+CO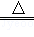 Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2; Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;
故答案为:样品由黑色变红色;CO、CO2;
(3)反应完后,操作顺序先撤酒精灯2,此时左边装置仍在制取CO,然后再关闭分液漏斗的开关,不再加入反应试剂,最后撤酒精灯1停止反应,这样操作防止空气中O2进入右边装置铜又被氧化为氧化铜了,正确的操作顺序为:熄灭酒精灯2,关闭漏斗开关,最后熄灭酒精1,即cab;
故答案为:cab;
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,剩余固体全部为铜,令样品中CuO的质量为m,则:
CuO+CO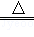 Cu+CO2,固体质量减少△m Cu+CO2,固体质量减少△m
80???????????????? 16
m???????????????? 5g﹣4.8g=0.2g
故m=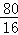 ×0.2g=1g, ×0.2g=1g,
所以原样品中金属铜的质量分数为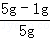 ×100%=80%; ×100%=80%;
故答案为:80%;
(5)①要测定铜的质量分数,可以把浓硫酸稀释,铜和稀硫酸不反应,氧化铜和稀硫酸反应,即可求出铜的质量分数.设计方案的主要步骤是将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可;
故答案为:将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可;
②反应的化学方程式为CuO+H2SO4=CuSO4+H2O;
故答案为:CuO+H2SO4=CuSO4+H2O.
点评:本题考查学生对实验原理与实验操作的理解、实验方案设计、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.
本题难度:一般
|
|
网站客服QQ: 960335752 - 14613519 - 791315772