微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 关于下列各实验装置的叙述中,不正确的是
 [???? ]
[???? ]
A.装置①可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
B.装置②中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
C.装置③可用于干燥、收集NH3,并吸收多余的NH3
D.装置④可用于分离C2H5OH和H2O的混合物
参考答案:D
本题解析:
本题难度:一般
2、选择题 (2011·广东六校模拟)用下图装置进行实验,下表中实验结果能说明结论的是( )
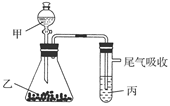
?
| 甲
| 乙
| 丙
| 结论
|
A
| 水
| 电石
| 溴水
| 稳定性:水>C2H2>Br2
|
B
| 盐酸
| 石灰石
| 苯酚钠溶液
| 酸性:HCl>H2CO3>苯酚
|
C
| 盐酸
| FeS
| 溴水
| 还原性:S2->Br->Cl-
|
D
| 浓盐酸
| KMnO4
| KBr溶液
| 氧化性:KMnO4<Cl2<Br2
?
参考答案:B
本题解析:物质之间发生反应,无法确定彼此稳定性的大小,A项错误;B项中发生的反应有:CaCO3+2HCl===CaCl2+H2O+CO2↑,C6H5ONa+H2O+CO2―→C6H5OH+NaHCO3,它们都属于酸与盐之间的复分解反应,符合强酸制弱酸的规律,可以说明酸性规律:HCl>H2CO3>苯酚,B项正确;C项中FeS+2HCl===FeCl2+H2S↑是非氧化还原反应,据此无法确定S2-、Cl-的还原性强弱,C项错误;D项中反应2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,Cl2+2KBr===2KCl+Br2均为氧化还原反应,根据氧化性强弱规律可确定氧化性的强弱顺序为KMnO4>Cl2>Br2,D项错误。
本题难度:一般
3、实验题 实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2+4HCl(浓)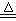 Cl2↑+MnCl2+2H2O Cl2↑+MnCl2+2H2O
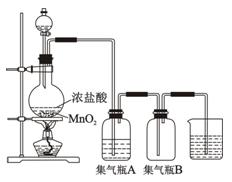
试回答下列问题:
(1)该反应是氧化还原反应吗?①???????(填“是”或“不是”),如果是氧化还原反应,指出②氧化剂是???????????,③还原剂是?????????????,④写出该反应的离子 方程式?????????????????????????????????????????????????????????????。 方程式?????????????????????????????????????????????????????????????。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯
化氢在饱和食盐水中的溶解度则很大),其作用是????????????????????????????。
(3)氯气溶于水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中
毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用???????????溶液来吸收有毒的氯气。
(4)一次实验中,加入浓盐酸200mL,其密度为1.19g·cm-3、HCl的质量分数为36.5%,
当MnO2刚好完全反应时,产生了5.6L(标准状况)的氯气。
试计算该浓盐酸的物质的量浓度和被氧化的HCl的物质的量。(请写出计算过程)
参考答案:(1)① 是;② MnO2;③ 浓盐酸;
④ 4H
本题解析:略
本题难度:简单
4、选择题 在实验室进行下列实验时,必须加碎瓷片以防暴沸的有
①制乙酸乙酯 ②制乙炔 ③制乙烯 ④蒸馏石油 ⑤裂化石蜡 ⑥制溴苯
A.①②③
B.②③④
C.①③④
D.④⑤⑥
参考答案:C
本题解析:液体加热至沸点以上或有气体生成时,应加碎瓷片以防暴沸。
本题难度:简单
5、计算题 (6分)某学生准备用质量分数为37%、密度为1.19 g·cm-3的浓盐酸配制0.10 mol·L-1的稀盐酸500 mL。请完成下列问题:
(1)量取浓盐酸的体积为_________ mL,应选用量筒的规格为_________ mL。
(2)配制时应选用容量瓶的规格为_________ mL。
(3)需用的仪器有:容量瓶、___________、___________、___________和试剂瓶等。
参考答案:(1)4.1? 5或10
(2)500
(3)烧
本题解析:根据所配制稀盐酸的物质的量的浓度和体积可以算出溶质的物质的量,再根据溶质的物质的量和质量分数可以求出溶液的质量,根据溶液的质量和密度可以求出量取浓盐酸的体积;量筒的规格选用应该遵循与溶液体积接近的原则;根据所配制稀盐酸的体积可以选用容量瓶的规格;根据配制的各步骤可以确定需用的仪器。
本题难度:简单
|