微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是
A.两个反应中均为硫元素被氧化
B.碘元素在反应①中被还原,在反应②中被氧化
C.氧化性:MnO2>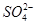 >
> >I2
>I2
D.反应①、②中生成等量的I2时转移电子数比为1∶5
参考答案:D
本题解析:反应①中为MnO2将NaI氧化,硫酸只起到提供酸性环境的作用,生成1 mol I2时转移电子2 mol;反应②中为NaHSO3将NaIO3还原,生成1 mol I2时转移电子10 mol;由反应②可知氧化性 >
> 本题难度:一般
本题难度:一般
2、选择题 S2-和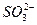 在酸性条件下可发生反应: S2-+
在酸性条件下可发生反应: S2-+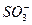 +H+——S↓+H2O(未配平),那么H+前的化学计量数应为(???)
+H+——S↓+H2O(未配平),那么H+前的化学计量数应为(???)
A.4
B.6
C.8
D.任意值
参考答案:B
本题解析:根据化合价升降法配平上述反应:2S2-+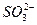 +6H+====3S↓+3H2O,故选B。
+6H+====3S↓+3H2O,故选B。
本题难度:简单
3、选择题 某金属的硝酸盐受热分解生成NO2、O2和该金属的氧化物。已知NO2和O2的分子个数
比为4:1,则在分解过程中该金属的化合价将:
A.无法确定
B.升高
C.不变
D.降低
参考答案:C
本题解析:N从+5到+4,共得到4个电子,O从-2到0,共失去4个电子,得失电子守恒。故金属的化合价不变。
本题难度:简单
4、填空题 (14分)实验室中所用少量氯气是用下列方法制取的,
4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
试回答下列问题:
(1)该反应是氧化还原反应吗????????,如果是氧化还原反应,请指出___????是氧化剂,??????是还原剂,_________是氧化产物,________是还原产物,根据上述氧化还原反应式判断氧化性:______﹥_______;还原性:______﹥_______。
⑵写出该反应的离子方程式?????????????????????_________???????
⑶用双线桥法标出该反应电子转移的方向和数目???? _______________________________
参考答案:. ⑴?是? MnO2? HCl? Cl2? MnCl2??
本题解析:
试题分析:(1)根据反应的方程式可知,氯元素的化合价从-1价升高到0价,而锰元素的化合价从+4价降低到+2价,所以属于氧化还原反应。其中氧化剂是二氧化锰,HCl是还原剂。氯气是氧化产物,而氯化镁是还原产物。由于在氧化还原反应中氧化剂的氧化性强于氧化产物的,还原剂的还原性强于还原产物的,所以氧化性和还原性强弱顺序分别是MnO2﹥Cl2、HCl﹥MnCl2。
(2)氯化氢和氯化锰都是可以拆开的,所以该反应的离子方程式是
4H++2Cl-+MnO2 本题难度:一般
本题难度:一般
5、填空题 有两份铜屑,将它们分别与足量的浓H2SO4和稀HNO3完全反应。若放出的气体在常温常压下体积相同,则这两份铜屑的质量比是________。
参考答案:2∶3
本题解析:写出铜分别与浓H2SO4和稀HNO3反应的化学方程式:
Cu+2H2SO4(浓)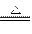 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O,可设都生成2 mol气体,则消耗的铜分别为2 mol、3 mol。故质量比2∶3。
本题难度:简单