微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某溶液X仅含下表离子中的5种(不考虑水的电离与离子水解),且各种离子的物质的量均为0.1mol某同学向溶液X中加入足量的盐酸,有气体生成,且反应溶液中阴离子的种类没有变化.下列说法正确的是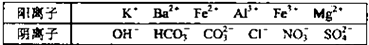
A.溶液X中可能含有HCO-3或CO2-3
B.溶液X中一定不存在Al3+、Ba2+,可能存在K+
C.向反应后的溶液中滴加KSCN溶液,无明显现象
D.向溶液X中加入足量的NaOH溶液,充分反应后过滤将沉淀,洗涤,干燥、灼烧至恒重,能得到固体质量为12g
参考答案:D
本题解析:分析:各种离子的物质的量均为0.1mol某同学向溶液X中加入足量的盐酸,有气体生成,且反应溶液中阴离子的种类没有变化.产生气体可能是碳酸根离子或碳酸氢根离子,若向原溶液中加入足量的盐酸,有无色气体生成,反应后溶液中阴离子种类没有变化,根据表中的离子,可以推知是 Fe2+、NO3-在酸性环境下生成的一氧化氮,加入盐酸,溶液中阴离子种类不变,所以原来溶液中含有Cl-,若只含有氯离子和硝酸根离子,二者的量均为0.1mol,根据电何守恒是不可能的,所以还含有硫酸根离子,再根据电荷守恒确定还含有一种带有两个正电荷的镁离子,所以含有的五种离子为:Cl-、NO3-、SO42-;Fe2+、Mg2+;
A、HCO3-与CO32-均可与盐酸反应生成二氧化碳;
B、根据离子共存知识和离子在溶液中的电荷守恒分析来回答;
C、若向溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变,说明原溶液中含有Cl-,该气体只能是NO,说明含有具有氧化性的NO3-和还原性的Fe2+,反应后溶液中含有三价铁离子;
D、根据元素守恒,0.1mol的Mg2+产生0.1mol的MgO,质量为4g,0.1mol的Fe2+产生0.05mol的Fe2O3,质量为8g,加起来一共就是12g.
解答:A、往溶液中加入的是过量的盐酸,如果有碳酸根离子或碳酸氢跟离子的话会完全反应生成二氧化碳,所以就不可能保证阴离子种类没变化,HCO3-与CO32-均可与盐酸反应生成二氧化碳,造成阴离子种类有所变化;故A错误;
B、依据分析推断可知,结合溶液中电荷守恒,溶液X中一定不存在Al3+、Ba2+、K+,故B错误;
C、反应后溶液中含有三价铁离子,向反应后的溶液中滴加KSCN溶液,溶液呈血红色;故C错误;
D、若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧到恒重,得到固体是三氧化二铁以及氧化镁,根据原子守恒,则生成0.05molFe2O3和0.1mol的MgO,质量为:0.05mol×160g/mol+0.1mol×40g/mol=12g,故D正确;
故选D.
点评:本题考查了离子性质的应用和实验方案的推断和分析判断,离子共存和离子变化特征,元素守恒和溶液中电荷守恒的计算应用是判断的关键,题目难度较大.
本题难度:困难
2、选择题 下列离子方程式的书写正确的是
A.将明矾加入氢氧化钡溶液中使硫酸根离子沉淀完全:Al3+++Ba2++4OH-+BaSO4↓+2H2O
B.将过量二氧化硫通入澄清石灰水中:SO2+OH-
C.向氯化铝溶液中加入过量氨水:Al3++4NH3?H2O++2H2O
D.稀硝酸和过量铁屑反应:Fe+4H++NO3-Fe3++NO↑+2H2O
参考答案:B
本题解析:分析:A.硫酸根离子沉淀完全,二者以1:2反应,生成2molBaSO4;
B.反应生成亚硫酸根离子;
C.反应生成氢氧化铝和氯化铵;
D.过量铁,反应生成Fe2+.
解答:A.至SO42-恰好沉淀完全的离子反应为Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O,故A错误;
B.将过量二氧化硫通入澄清石灰水中的离子反应为SO2+OH-═HSO3-,故B正确;
C.向氯化铝溶液中加入过量氨水的离子反应为Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故C错误;
D.稀硝酸和过量铁屑反应的离子反应为3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故D错误;
故选B.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意与量有关的离子反应,选项D中Fe过量为易错点,题目难度中等.
本题难度:简单
3、选择题 能正确表示下列反应的离子方程式是 ( )。
A.用铜做电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+
2Cu+O2↑+4H+
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
C.明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+
D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
参考答案:D
本题解析:用铜做电极电解CuSO4溶液,阳极Cu-2e-=Cu2+,阴极Cu2++2e-=Cu,A错;钠与CuSO4溶液反应,Na先与水反应,生成的NaOH再与硫酸铜反应,B错;铝离子水解不能进行到底,中间用可逆符号,生成的是Al(OH)3胶体,不写沉淀符号,C错。
本题难度:一般
4、填空题 某待测溶液中可能含有Ag+、Fe3+、Na+、Mg2+、Ba2+、Al3+等离子,进行如下实验:①加入过量的稀盐酸,有白 色沉淀生成。②过滤,在滤液中加入过量的稀硫酸,又有白色沉淀。③过滤,取少量滤液,滴入KSCN溶液,没有明显的现象出现。④另取少量步骤③中的滤液,加入NaOH溶液至溶液呈碱性,无明显现象。⑤另取少量步骤④反应后的溶液,焰色反应呈黄色。根据实验现象回答:
(1)待测液中一定含有的离子是??????????????????????????????。
(2)待测液中一定不含有的离子是????????????????????????????。
(3)待测液中不能确定是否存在的离子是??????????????????,要检测这种离子的实验方法是(填写实验名称和观察到的现象,不要求写实验操作过程)??????????????????。
参考答案:(每空2分)?(1)Ag+、Ba2+???(2)Fe3+、M
本题解析:
试题分析:加入过量的稀盐酸,有白色沉淀生成,说明溶液中含有Ag+。过滤,在滤液中加入过量的稀硫酸,又有白色沉淀,这说明溶液中还含有Ba2+。过滤,取少量滤液,滴入KSCN溶液,没有明显的现象出现,说明溶液中不存在Fe3+。另取少量步骤③中的滤液,加入NaOH溶液至溶液呈碱性,无明显现象,这说明溶液中没有Mg2+ 、Al3+。另取少量步骤④反应后的溶液,焰色反应呈黄色,说明含有钠离子。但由于在实验过程中加入了氢氧化钠溶液,所以不能确定是否含有钠离子。要检测是否含有钠离子,正确的实验操作是取原待测液做
本题难度:一般
5、选择题 用下面的方案进行某些离子的检验,其中方案设计得最严密的是(???)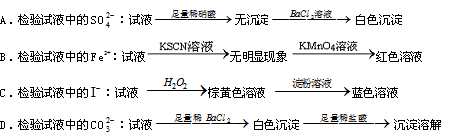
参考答案:C
本题解析:
正确答案:C
A、Ag+ 干扰;B、SCN―被MnO42―氧化;C、正确;D、SO32―干扰。
本题难度:一般