微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,等物质的量SO2和H2S 气体,在一定容积的密闭容器中充分反应后,恢复到原温度,容器内压强变为原来的(?)
A.1/2
B.1/3
C.<1/4
D.>1/4
参考答案:C
本题解析:略
本题难度:简单
2、实验题 某课外兴趣小组为探究铜跟浓硫酸反应情况,用下图所示装置进行实验。已知:①SO2难溶于饱和亚硫酸氢钠溶液;②SO2能与酸性高锰酸钾溶液发生氧化还原反应使之褪色(化学方程式为5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4)。
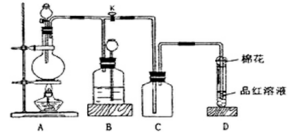
回答下列问题(注:E为止水夹,F为旋塞):
(1)检查A装置的气密性的方法????????????。
(2)装置A中反应的化学方程式为???????????。
(3)装置D中试管口放置的棉花应蘸有NaOH溶液,
其作用是??????????????。
(4)装置B具有贮存气体的作用。当D处有明显的现象后,关闭旋塞F并移去酒精灯,由于余热的作用,A处仍有气体产生,此时B中的现象是???????????????,B中应放置的液体是(填字母)???????????。
A.水
B.饱和NaHSO3溶液
C.酸性KMnO4溶液
D.NaOH溶液
(5)该小组学生做了如下实验:取一定质量的铜片和一定体积18.4 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中没有铜片剩余。往反应后的溶液中加入足量的BaCl2溶液,获得沉淀3.495 g;产生的气体恰好使200ml 0.01mol·L-1的酸性高锰酸钾溶液褪色,则实验中取用的硫酸的物质的量为???????????。
参考答案:(1)夹紧水夹E,关闭分液漏斗旋塞,往分液漏斗中加水,打开分
本题解析:
试题分析:(1)检查A装置的气密性的方法是夹紧水夹E,关闭分液漏斗旋塞,往分液漏斗中加水,打开分液漏斗旋塞,若漏斗中水滴入部分后便停止,证明气密性好。若水一直滴入,则气密性不好。(2)在装置A浓 与Cu发生反应,化学方程式为H2SO4(浓)+Cu CuSO4+SO2↑+2H2O. (3)SO2是大气污染物
CuSO4+SO2↑+2H2O. (3)SO2是大气污染物
本题难度:一般
3、选择题 某同学利用下列装置进行浓硫酸和铜反应并验证二氧化硫的性质。按如图实验装置连接仪器和放置药品。加热浓硫酸约1分钟后撤去酒精灯,将铜丝插入液面,反应一段时间后拔出。实验结束后会看到两个试管的液体底部均有少量的白色固体。下列对该实验的现象分析或推断正确的是

A.湿润的蓝色石蕊试纸先变红后褪色
B.左边试管出现的白色固体是由于浓硫酸的脱水性所致
C.从该实验的描述中可以体会出铜与浓硫酸的反应是一个放热反应
D.本实验体现了二氧化硫的酸性、漂白性和弱氧化性
参考答案:C
本题解析:
试题分析:A、SO2不能漂泊石蕊,所以蓝色石蕊试纸变红,不会褪色,错误;B、Cu与浓硫酸反应生成CuSO4,左边试管出现的白色固体为无水CuSO4,错误;C、加热浓硫酸约1分钟后撤去酒精灯,反应继续进行,说明铜与浓硫酸的反应是放热反应,正确;D、湿润的蓝色石蕊试纸变红,体现了SO2溶于水后显酸性,吸有品红溶液的滤纸褪色,体现了SO2的漂白性,但本实验无法证明二氧化硫的弱氧化性,错误。2的性质。
本题难度:一般
4、选择题 如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是 ( )

选项
| 试剂
| 现象
| 结?论
|
A
| 酸性KMnO4溶液
| 溶液褪色
| SO2有氧化性
|
B
| 品红溶液
| 溶液褪色
| SO2有漂白性
|
C
| NaOH溶液
| 无明显现象
| SO2与NaOH
溶液不反应
|
D
| 紫色石蕊试液
| 溶液变红色后不褪色
| SO2有酸性,没有漂白性
参考答案:B
本题解析:
试题分析:A.证明SO2有还原性,错误;B.使品红溶液褪色是SO2有漂白性,正确;C. SO2与NaOH溶液发生反应,由于产物容易溶于水,也没有明显的颜色变化等,所以无明显现象,错误;D. SO2使紫色石蕊试液变红色后不褪色,是因为SO2与水反应产生了酸有酸性,但是其只能使某些有色物质褪色,而不是使所有有色物质褪色,错误。2的性质及检验的知识。
本题难度:一般
5、选择题 向某盐溶液中加入BaCl2溶液,再加入稀HNO3至溶液呈酸性,有白色沉淀产生,该溶液中可能有( )?
A.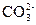
B.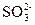
C.Ag+
D.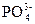 ? ?
参考答案:BC
本题解析:四种阴离子与Ba2+反应的产物分别是BaCO3、BaSO3、AgCl、Ba3(PO4)2,再加稀HNO3,BaCO3和Ba3(PO4)2能溶于其中,BaSO3能被稀HNO3氧化为BaSO4,BaSO4、AgCl不溶于稀HNO3。
本题难度:简单
|