微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 硝酸大量用于制造无机肥料,如硝酸铵、硝酸钙、硝酸磷肥,还广泛用于其他工业生产。硝酸工业生产流程图如下图所示:
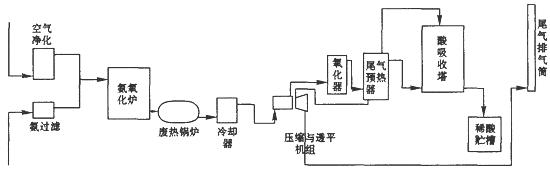
(1)第—步是氨的接触氧化,在一定温度下以铂铑网作为催化剂,写出该反应的化学方程式??????????。
(2)在吸收塔中用水循环吸收NO2得到硝酸,写出发生该反应的化学方程式??????????????????????,该过程是放热的,为了使吸收效果更好,在吸收过程中需要控制在???????????????????条件下。
(3)尾气中含有氮的氧化物,直接排放到空气中会危害环境,写出一项氮的氧化物可能引起的环境问题?????????????????。工业上常用纯碱溶液吸收NO2,生成亚硝酸盐、硝酸盐和其他物质,写出该反应的化学方程式??????????????????????。
参考答案:
(1)4NH3+5O2 本题解析:
本题解析:
试题分析:(1)氨气的催化氧化,反应方程式是:4NH3+5O2 4NO+6H2O;(2)二氧化氮与水反应的化学方程式是:3NO2+H2O=2HNO3+NO;?该反应是放热,低温促进反应正向移???动,正反应气体体积减小,增大压强,反应正向移动,所以使吸收效果更好在吸收过程中需要控制低温高压下;故答案为:3
4NO+6H2O;(2)二氧化氮与水反应的化学方程式是:3NO2+H2O=2HNO3+NO;?该反应是放热,低温促进反应正向移???动,正反应气体体积减小,增大压强,反应正向移动,所以使吸收效果更好在吸收过程中需要控制低温高压下;故答案为:3
本题难度:一般
2、选择题 20世纪90年代初,国际上提出了“预防污染”的新概念.“绿色化学”是预防污染的基本手段,下列各项中属于“绿色化学”的是( )
A.处理废弃物
B.杜绝污染源
C.禁食有毒物
D.制定治污规章制度
参考答案:B
本题解析:
本题难度:一般
3、填空题 (12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.用于合成氨的工业煤气中含有H2S、C2H5SH(乙酸醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理。
H2S+ZnO=ZnS+H2O;C2H5SH+ZnO=ZnS+C2H4+H2O
C2H5SH+H2=C2H6+H2S;COS+H2=CO+H2S;CS2+4H2=CH4+2H2S
(1)钴原子在基态时核外电子排布式为?????????。
(2)下列有关分子结构的说法正确的是???????????。
A.C2H4分子中有5个 键处1个
键处1个 91EXAM.org键
91EXAM.org键
B.COS分子(结构如右图)中键能C=O>C=S
C.H2S分子呈V形结构
D.CH4、C2H6分子中碳原子均采用sp3杂化
(3)下列有关说法不正确的是?????。
A.H2O、CO、COS均是极性分子
B.相同压强下沸点:Cs2>COS >CO2
>CO2
C.相同压强下沸点:C2H 5SH>C2H5OH
5SH>C2H5OH
D.相同压强下沸点:CO>N2
(4)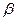 -ZnS的晶胞结构如右图,晶胞中S2-数目为:????????个。
-ZnS的晶胞结构如右图,晶胞中S2-数目为:????????个。
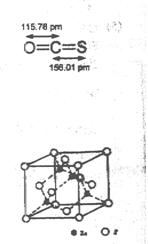
(5)具有相似晶胞结构的ZnS和ZnO,ZnS熔点为1830℃,ZnO熔点为1975℃,后者较前者高是由于????????????。
(6)钼的一种配合物化学式为:Na3[Mo(CN)8]·8H2O,中心原子的配位数为???。
B.烃醛结合反应有机合成中颇为重要,绿色催化剂的固体铌酸酸倍受研究者关注。铌酸具有较高的催化活性及稳定性。反应原理如下:
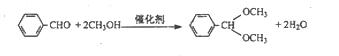
实验方法是在25mL烧瓶中加入铌酸、10mL甲醇和 0.5mL苯甲醛,在回流状态下反应2h,反应的产率和转化率均非常高。
(1)采用回流反应2h的目的是?????????????。
(2)在反应中甲醇需过量,其原因是??????????????。
 ?(3)不同铌酸用量对产率和转化率影响,如下表:
?(3)不同铌酸用量对产率和转化率影响,如下表:
铌酸用量/mol
| 0.01
| 0.02
| 0.03
| 0.05
| 0.1
| 0.15
| 0.2
| 0.6
|
产率%
| 87.3
| 88.2
| 90.3
| 94.2
| 92.9
| 93.1
| 91.8
| 92.3
|
转化率%
| 89.7
| 92.1
| 93.9
| 98.9
| 94.9
| 95.7
| 93.9
| 94.3
??????在上述苯甲醛与甲醇缩合反应实验中催化剂铌酸的最佳用量为????????。
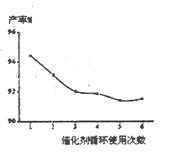
(4)催化剂的回收利用性能是考察催化剂的一项极为重要的指标。铌酸催化剂循环使用次数对产率的影响如右下图,这说明铌酸催化剂的优点之一是?????????。
(5)用铌酸作催化剂时,不同的醛与甲醇的缩合反应的转化率和产率如下表:
序号
| 醛
| 醇
| 转化率%
| 产率%
| 1
| 邻羟基苯甲醛
| 甲醇
| 94.3
| 89.6
| 2
| 邻羟基苯甲醛
| 甲醇
| 93.6
| 88.7
| 3
| 邻氯苯甲醛
| 甲醇
| 93.1
| 87.3
| 4
| 间硝基苯甲醛
| 甲醇
| 54.2
| 34.1
| 5
| 邻硝基苯甲醛
| 甲醇
| 89.9
| 79.5
| 6
| 对硝基苯甲醛
| 甲醇
| 65.7
| 41.9
从表中得出的不同的醛与甲醇缩合反应影响转化率和产率的规律是???。
参考答案:A.(12分),每空均为2分
(1)[Ar]3d74s
本题解析:略
本题难度:简单
4、选择题 绿色化学的最大特点在于它是在始端就采用实现污染预防的科学手段,因而过程和终端均为零排放或零污染。绿色化学主张在通过化学转换获取新物质的过程中充分利用每个原子,具有“原子经济性”,因此它既能够充分利用资源,又能够防止污染。下列化学反应,不符合绿色化学概念的是 [???? ]
A.制Cu(NO3)2: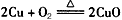 , CuO+2HNO3(稀) = Cu(NO3)2+H2O , CuO+2HNO3(稀) = Cu(NO3)2+H2O
B.消除制硝酸工业尾气的氮氧化物污染 NO2+NO+2NaOH = 2NaNO2+ H2O, 2NO2+2NaOH = NaNO2+NaNO3+H2O
C.利用二氧化碳制造易降解塑料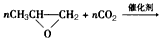 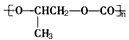
D.用铜与浓硫酸共热制硫酸铜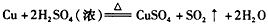
参考答案:D
本题解析:
本题难度:简单
5、实验题 某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2) ,现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进人有机层的过程)和反萃取(铜从有机层进人水层的过程)是现代湿法炼铜的重要工艺手段。
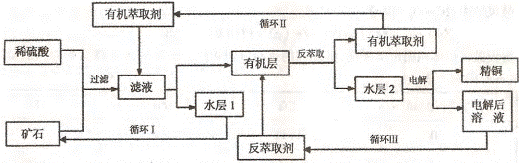
已知:①Cu2O+2H+=Cu2++Cu + H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜; ③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu + H2O
???????????????????????、??????????????????????????(写其中2个)
(2)将有机层和水层分离的操作方法叫????????,实验式完成此操作所用到的一种主要仪器是??????????????????。
(3)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体的化学式是??????????。
(4)写出电解过程中(两电极都是惰性电极)阴极发生反应的电极反应式???????????????
(5)“循环Ⅲ”中反萃取剂的主要成分是???????????????????????????????
参考答案: 本题解析:略 本题解析:略
本题难度:简单
|
|