微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 铜的摩尔质量为M g/mol,密度为d g/cm3,阿伏加德罗常数为NA,下列说法正确的是(?)。
A.1 kg铜所含原子的数目为d NA
B.一个铜原子所占有的体积为(M/d)NAcm3
C.一个铜原子的质量为M/NAg
D.1 dm3铜所含有的原子数为 d NA/M
参考答案:C
本题解析:1 kg铜物质的量为1000/M mol,所以含原子数为1000NA/M,故A错。1 mol铜的体积是M/d,1个铜原子所占有的体积为(M/d)/NA?cm3,所以B错。1 mol铜的质量为M g,含NA个铜原子,1个铜原子的质量为M/NA g,即C正确。1dm3铜的质量是1000d g,铜的物质的量为1000d/M mol,所以含原子数目为1000dNA/M,即D错。
本题难度:简单
2、选择题 向50 mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10 mL,将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是(?)

A.OA段所发生反应的离子方程式: H++OH-=H2O;CO32-+H+=HCO3-
B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1∶1。
C.产生的CO2体积(标准状况下)为0.056 L
D.原NaOH溶液的物质的量浓度为0.5 mol·L-1
参考答案:D
本题解析:
试题分析:OA段消耗盐酸50ml,生成CO2气体需要盐酸25ml,说明CO2与NaOH溶液反应生成了Na2CO3,并且NaOH过量,OA段发生的反应为:H++OH-=H2O;CO32-+H+=HCO3-, AB段发生的反应为HCO3?+H+=CO2+H2O,与NaOH反应和与Na2CO3反应的HCl的量相等,故A项、B项正确;根据段消耗了盐酸25ml,可求出CO2的体积:0.025ml×0.1mol/L×22.4L/mol=0.056L,故C项正确;B点时,恰好反应生成NaCl,根据Na元素守恒和
本题难度:一般
3、选择题 过量的硝酸和6.4g铜充分反应,向反应后的溶液中滴加5 mol·L-1的氢氧化钠溶液,加入氢氧化钠溶液的体积与生成沉淀的关系如图所示,则反应后溶液中所含NO3-的物质的量为

A.0.05mol
B.0.1mol
C.0.2mol
D.0.25mol
参考答案:D
本题解析:
试题分析:铜与稀硝酸反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.由于硝酸过量,加入的氢氧化钠溶液首先和过量的硝酸反应生成硝酸钠,然后再与硝酸铜溶液反应产生氢氧化铜沉淀。反应后的溶液为硝酸铜和硝酸钠混合液。与硝酸反应消耗的氢氧化钠为10ml,所以硝酸钠中硝酸根离子为:n((NO3-)=n(Na+)="0.01×5" mol∕L="0.05" mol.n(Cu)=m∕M=6.4g∕64(g∕mol)=0.1mol.? n{Cu(NO3)2}=0.1mol,硝酸铜中的
本题难度:一般
4、选择题 下表为四种溶液的溶质质量分数和物质的量浓度的数值,根据表中数据判断四种溶液中密度最小的是
溶液
| KOH
| HNO3
| CH3COOH
| HCl
|
溶质质量分数w(%)
| 56
| 63
| 60
| 36.5
|
物质的量浓度c(mol·L-1)
| 14.3
| 13.8
| 10.6
| 11.8
?
A.HCl??????????B.HNO3?????????C.CH3COOH?????????D.KOH
参考答案:C
本题解析:设溶液的密度为ρ(g/L),体积为V(L),溶质的摩尔质量为M(g·mol-1),则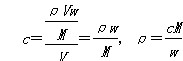 ,代入可计算出CH3COOH溶液的密度最小。 ,代入可计算出CH3COOH溶液的密度最小。
本题难度:一般
5、选择题 下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是??

[? ?? ]
A.该硫酸的物质的量浓度为9.2 mol·L-1
B.1 mol铁加入到足量的该硫酸中,可产生2 g H2
C.该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol·L-1
D.配制200 mL4.6 mol·L-1的硫酸溶液需取该硫酸50 mL
参考答案:D
本题解析:
本题难度:简单
|