微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 用离子交换法从海带中提取碘是一种较为先进的制碘工艺应用技术。
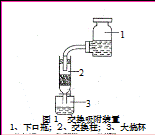
①浸泡海带:取海带500g,加13~15倍水量分两次浸泡,得浸出液6000mL左右,碘含量为0.5g/L。?
②碱化浸出液除褐藻糖胶:即海带浸出液1000mL,加入浓度为40% 的NaOH溶液,控制pH值为12左右,充分搅拌后使褐藻酸钠絮状沉淀而沉降。采用倾析法分离出清液。
③氧化游离:向上述清液中加入浓度为6mol× L-1的H2SO4溶液,使pH值为1.5~2。往酸化后溶液中加入NaClO溶液或H2O2溶液,充分搅拌并观察溶液颜色变化。待溶液由淡黄逐渐变成棕红色即表明I-离子已转变为多碘离子(I3-)。
④交换吸附:氯型强碱性阴离子交换树脂(R—Cl表示)注入交换柱中(树脂层高度为12cm),如右图连接交换装置,待溶液全部通过后,树脂颜色变为黑红色。
⑤洗脱:分两步进行
第一步:取8~10% 的NaOH溶液40mL注入交换柱中。在强碱作用下,树脂颜色逐渐变浅,待树脂基本褪色后,放出溶液,收集于一小烧杯中为碱性洗脱液。????
第二步:取10% 的NaCl溶液40mL注入上述交换柱中。稍待一会儿,慢慢放出溶液收集于另一小烧瓶中,为氯化钠洗脱液。
⑥往碱性洗脱液中滴加H2SO4溶液(6mol/L),烧杯底部会析出一层泥状粗碘。
⑦往氯化钠洗脱液中滴加H2SO4溶液(6mol/L)使之酸化,再滴加10% 的NaNO2溶液(在通风橱中进行)。待溶液由无色转变为棕红色直至出现棕黑色浑浊。
⑧离心分离即得粗碘。
试回答下列问题
(1)步骤③在酸性条件下用NaClO(或H2O2)氧化碘的离子方程式:?? ? ?,
及I2 +I-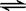 I3-。如何用化学方法检验有多碘离子生成?????????????????????。
I3-。如何用化学方法检验有多碘离子生成?????????????????????。
(2)第④步发生的离子反应为:????????????????????????????。
(3)步骤⑤洗脱时第一步发生的离子反应为(洗脱液中含有I-和IO3-离子):
???????????;第二步洗脱发生的离子反应为:?????????????????。
(4)步骤⑦发生反应的离子方程式为 ????????????????????????????????。
2、选择题 下列说法正确的是
A.石油的炼制过程都是化学变化过程
B.石油分馏目的是将含碳原子数较多的烃先气化,后经冷凝而分离出来
C.石油经石油分馏、催化裂化等工序炼制后即能制得纯净物
D.石油分馏出来的各馏分仍是多种烃的混合物
3、选择题 中学阶级介绍的应用电解法制备的物质主要有三种:一是铝的工业制备、二是氯碱工业、三是金属钠的制备。下列关于这三个工业生产的描述中正确的是(???)
A.电解法制金属钠时,负极反应式:Na++e-=Na
B.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性
C.在氯碱工业中,电解池中的阴极产生的是H2 , NaOH 在阳极附近产生
D.氯碱工业和金属钠的冶炼都用到了NaCl ,在电解时它们的阴极都是 C1一失电子
4、选择题 绿色化学提倡化工生产应提高原子利用率。在下列制备环氧乙烷的反应中,原子利用率最高的是 [???? ]
A.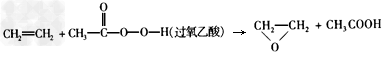
B.CH2=CH2+Cl2+Ca(OH)2→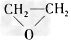 +CaCl2+H2O
+CaCl2+H2O
C.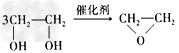 + HOCH2CH2-O-CH2CH2OH+2H2O
+ HOCH2CH2-O-CH2CH2OH+2H2O
D.2CH2=CH2?+?O2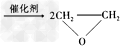 ??
??
5、填空题 最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功。
具体生产流程如下:
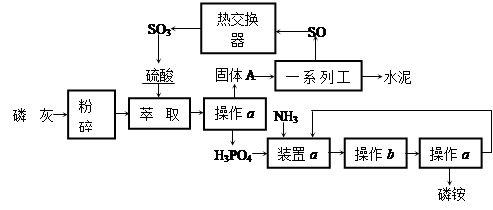
回答下列问题:
(1)操作a的名称是________,实验室中进行此操作的非玻璃仪器或用品有__________;在实验室中操作b的名称是________________________。
(2)装置a中生成两种酸式盐,它们的化学式分别是____________________________ 。
(3)依题意猜测固体A中一定含有的物质的化学式是__________(结晶水部分不写)。
(4)“热交换器”是利用“废热”预热_____________,除此之外还可利用硫酸工业的“废热”_________。
(5)SO3在______________(填设备名称)中用______________吸收转化为发烟硫酸。