微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉(Cd)是一个有益的尝试,其流程如下:
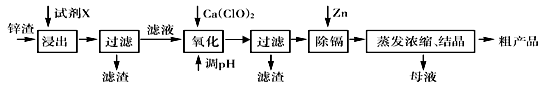
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7。试回答下列问题:
(1)浸出时用到的试剂X为 , 写出溶解过程中加快浸出速率和提高浸出率的两点措施:_______________________________,______________________________。
(2)写出加入Ca(ClO)2反应的离子方程式 。
(3)调节pH过程可以选用 (填“ZnO”或“NaOH”);本流程的pH调节一般调至5,其目的是 。
(4)写出过滤后加入过量的锌粉反应的离子方程式 。
(5)在蒸发浓缩操作时,要采取实验措施是: 。
参考答案:(1)H2SO4溶液 适当
本题解析:
试题分析:(1)本题是制备硫酸锌晶体的的工艺流程,锌渣中含有难溶的二氧化硅杂质,选用酸溶除去二氧化硅,考虑尽量少引入杂质,应选含有硫酸根离子的硫酸溶液进行溶解。若要加快浸出速率和提高浸出率,可以适当升高温度或搅拌溶液或适当延长时间等。
(2)用硫酸浸出的滤液中含有少量Fe3+、Al3+、Zn2+、Cd2+、Fe2+ 等离子,考虑这些离子分别沉淀的pH值,应该把Fe2+ 氧化为Fe3+ 在沉淀除去,所以加入氧化剂Ca(ClO)2 发生的反应方式为:2H++ClO—+2Fe2+ =Cl—+2Fe3++H2O。
(3)由于整个流程制备的是硫酸锌晶体,所以在调节pH时要注意不能引入杂质,所以应该选用ZnO调节,而调节pH值到5左右目的是使容易沉淀的Fe3+、Al3+ 先沉淀除去,防止pH过高把生成的Al(OH)3溶解、把Zn2+ 沉淀。
(4)在上步调节完pH后,溶液中还存在杂质离子Cd2+ ,由于Cd2+ 沉淀的pH值与Zn2+ 沉淀的pH值相近,所以不能用沉淀法除去,所以要加入单质Zn把Cd置换出来,因此发生的离子方程式为:Zn+Cd2+=Zn2++Cd。
(5)硫酸锌在蒸发浓缩时容易发生水解,所以为了减少水解产生杂质,应该保持溶液一定的酸度。
考点:本题考查的是化学工艺流程题,本题考的比较基础,常规题型较多。
本题难度:困难
2、选择题 下列实验不能达到目的的是
选项
| 实验操作
| 实验目的
|
A
| 向5 mL 0.1 mol/L AgNO3溶液中滴加3滴0.1 mol/LNaCl溶液,产生白色沉淀;再向其中滴加3滴0.1mol/L的KI溶液,有黄色沉淀产生
| 验证Ksp(AgCl)> Ksp(AgI)
|
B
| 向适量样品溶液中滴加KSCN溶液
| 检验FeSO4溶液是否被氧化
|
C
| 向适量样品溶液中滴加盐酸酸化,再滴加BaCl2溶液
| 检验Na2SO3溶液是否被氧化
|
D
| 向Na2SiO3溶液中通入CO2
| 验证非金属性:碳>硅
参考答案:A
本题解析:A中滴加的NaCl不能使溶液中Ag+完全沉淀,因而不能得到Ksp(AgCl)> Ksp(AgI)的结构;如果加入KSCN溶液显红色,可以证明Fe2+被氧化了;先加盐酸酸化,如果没有现象,再加氯化钡溶液,产物白色沉淀,则证明有SO42-,可以检验FeSO4溶液是否被氧化;向向Na2SiO3溶液中通入CO2,是高价含氧酸间的强酸制弱酸,可以证明非金属性:碳>硅。
本题难度:一般
3、选择题 下列有关AgCl沉淀的溶解平衡的说法中,不正确的是[???? ]
A.AgCl沉淀生成和溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低
参考答案:B
本题解析:
本题难度:一般
4、选择题 已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16 ,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A.AgCl>AgI> Ag2CrO4
B.Ag2CrO4>AgCl>AgI
C.AgCl> Ag2CrO4>AgI
D.Ag2CrO4>AgI>AgCl
参考答案:B
本题解析:
试题分析:根据对应化学式相似的AgCl和AgI来说Ksp越小Ag+浓度越小,即AgCl>AgI;假设Ag2CrO4饱和溶液中Ag+的浓度为x,则CrO42-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2CrO4)=x2×0.5x=0.5x3=2.0×10-12,x3=4.0×10-12,即X=
本题难度:一般
5、填空题 氧化铁在工业上具有广泛的应用。
I.据报道,一定条件下利用FeO2与甲烷反应可制取“纳米级”的金属 铁。其反应如下:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
(1)若反应在2L的密闭容器中进行,5min后达到平衡,测得反应生成Fe的质量为l.12g。则该段时间内CH4的平均反应速率为 ________________。
(2)反应达到平衡后,保持其他条件不变,仅改变某一相关元素,下列说法正确的是___(选填序号)。
a.若加入催化剂,v正增大,平衡向右移动
b.若温度升高,平衡常数K减小
c.若增大Fe2O3的量,平衡向右移动
d.若从反应体系中移走部分CO,可提高CH4的转化率
Ⅱ.工业上利用硫铁矿烧渣(主要成分为Fe2O3、A12O3、SiO2等)为原料提取Fe2O3,工艺
流程如下:试回答下列问题:
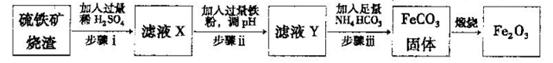
(3)步骤i烧渣中A12O3溶解的离子方程式为________________。
(4)步骤i、
参考答案:
本题解析:
本题难度:困难
|