微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4
??△??
.
?
2CaSO4+2Cl2↑+2H2O.他们设计了如下制取氯气并验证其性质的实验.
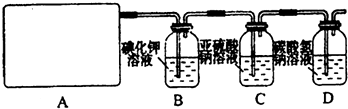
试回答:(1)该实验中A部分的装置是______(填写装置的序号).
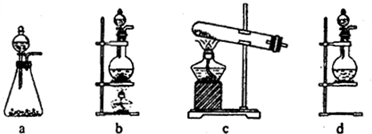
(2)(1)选项中d装置的两个主要的玻璃器皿的名称分别是______、______.
(3)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):______.
(4)分别写出C装置、D装置发生反应的离子方程式______.
(5)该实验存在明显的缺陷,请你从化学反应的视角提出改进的方法是______.所发生反应的化学方程式是______.
(6)该小组又进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取25mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置.待完全反应后,用0.1mol/L的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应方程式为:
2Na2S2O3+I2═Na2S4O6+2NaI?反应完成时,共用去Na2S2O3?20.0mL.则该漂白粉中Ca(ClO)2的质量分数为______.(保留至0.01%)
参考答案:(1)A部分用于制取Cl2,根据所给Cl2的生成反应的反应物
本题解析:
本题难度:一般
2、选择题 IBr+H2O==HBr+HIO下列关于IBr有关性质的叙述中,正确的是(??)
A.与水反应中既是氧化剂又是还原剂
B.与NaOH反应生成溴化钠和次碘酸钠
C.可作氧化剂
D.与水反应是氧化还原反应
参考答案:BC
本题解析:A、因IBr中I元素的化合价为+1价,Br为-1价,HBr中Br为-1价,HIO中I为+1价,则IBr+H2O═HBr+HIO中没有元素化合价的变化,该反应属于非氧化还原反应,则IBr与水反应时既不做氧化剂,也不做还原剂,故A错误;D也错误。
B.与NaOH反应生成溴化钠和次碘酸钠,正确;
C.溴化碘的化学性质与卤素单质相似,则IBr中I元素的化合价为+1价,I元素的化合价在反应中能降低,则在很多化学反应中IBr是强氧化剂,故C正确;
选BC
本题难度:一般
3、选择题 在新制的氯水中,能大量存在的粒子是
A.H+
B.I-
C.Ag+
D.Fe2+
参考答案:A
本题解析:略
本题难度:简单
4、选择题
A.NH3·H2O
B.BaCl2
C.NaOH
D.HCl
参考答案:A
本题解析:B、D中滴入AgNO3(aq)开始即生成白色沉淀,且沉淀不再溶解。C中滴入AgNO3(aq),生成白色AgOH沉淀,且AgOH沉淀不稳定,在溶液中发生分解反应生成Ag2O,所得暗棕色沉淀(AgOH和Ag2O的混合物)也不溶解。A中滴入少量AgNO3,发生以下反应:Ag++3NH3·H2O====[Ag(NH3)2]++NH4++OH-+2H2O,故无沉淀产生;继续滴入AgNO3(aq),至AgNO3过量时,总反应如下:Ag++NH3·H2O====AgOH↓+NH4+,故有沉淀产生。
本题难度:一般
5、选择题 下列关于S、Si、N、Cl等非金属元素化合物的说法正确的是??????(???)
A.SiO2是制造太阳能电池板的主要材料
B.NO、NO2是大气污染物,能在空气中稳定存在
C.漂白精的有效成分是Ca(ClO)2
D.Fe与S化合生成Fe2S3
参考答案:C
本题解析:A:高纯硅是制造半导体、晶体管的主要材料,并非SiO2,不正确
B:NO可与氧气在常温下反应生成NO2,不正确
C:正确
D:硫的氧化性较差,Fe与S化合生成FeS
本题难度:一般
|