微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在下列各物质中加入过量盐酸后,最终不产生沉淀或浑浊的是
A.偏铝酸钠溶液
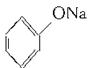
B.苯酚钠溶液
C.硅酸钠溶液
D.硫代硫酸钠溶液
参考答案:A
本题解析:AlO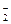 在HCl过量的情况下变成Al3+,即NaAlO2+4HCl===NaCl+AlCl3+2H2O为
在HCl过量的情况下变成Al3+,即NaAlO2+4HCl===NaCl+AlCl3+2H2O为
本题难度:简单
2、填空题 过碳酸钠(2Na2CO3·3H2O2)是一种新型高效固体漂白杀菌剂,它具有无臭、无毒、无污染的特点,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中。依托纯碱厂制备过碳酸钠可降低生产成本,其生产流程如下:
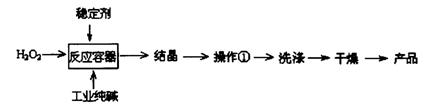
试回答下列问题:
(1)过碳酸钠溶于水后所得溶液一定显???????????????(“酸性”、“碱性”或“中性”)。
(2)操作①需要的玻璃仪器有????????????????????????????????????(填写仪器名称)。
(3)工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。
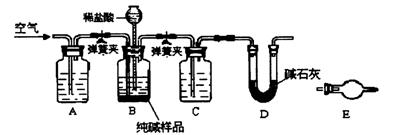
①要检验工业纯碱中杂质的存在,最好选用下列试剂中的??????????(选填序号)。
a.氢氧化钡溶液? b.稀硝酸? c.硫氰化钾溶液? d.硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈 漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若?????????????????,说明装置不漏气。
漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若?????????????????,说明装置不漏气。
③装置A的作用是????????????????,装置C中的试剂为???????????????。
④某同学认为在D装置后应再连接E装置(装有适当试剂),你认为是否必要?????
(选填“必要”或“不必要”),判断的理 由是??????????????????????????????????????????。
由是??????????????????????????????????????????。
参考答案:(1)碱性(2分)?(2)普通漏斗?烧杯?玻璃棒(3分)?(
本题解析:略
本题难度:一般
3、计算题 (8分)加热10.0克碳酸钠和碳酸氢钠混合物质质量不再变化,剩余固体的质量为8.45克,求混合物中碳酸钠的质量分数。
参考答案:58%
本题解析:可依据差量法计算
2NaHCO3=Na2CO3+H2O+CO2↑???△m
2×84g??????????? 18??? 44????? 62
m???????????????????????????? 10.0—8.45
m=4.2g
故碳酸钠的质量分数为: =58%
=58%
本题难度:一般
4、填空题 切开的金属Na暴露在空气中,其变化过程如下:

(1)反应Ⅰ的反应过程与能量变化的关系如下:
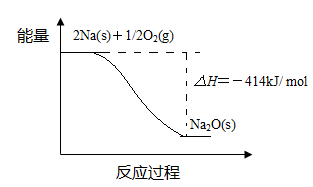
① 反应Ⅰ 是 反应(填“放热”或“吸热”),判断依据是 。
② 1 mol Na(s)全部氧化成Na2O(s)的热化学方程式是 。
(2)反应Ⅱ是Na2O与水的反应,其产物的电子式是?????。
(3)白色粉末为Na2CO3。将其溶于水配制为0.1 mol/L Na2CO3溶液,下列说法正确的是?????(填字母)。
A.升高温度,溶液的pH降低
B.c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3)
C.加入少量NaOH固体,c (CO32―)与c (Na+)均增大
D.c (Na+) > c (CO32―) > c (HCO3―) > c(OH―) > c (H+)
(4) 钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题。
① 钠比锂活泼,用原子结构解释原因_______。
②ZEBRA 电池是一种钠电池,总反应为NiCl2 + 2Na  ?Ni + 2NaCl。其正极反应式是_____。
?Ni + 2NaCl。其正极反应式是_____。
参考答案:(1)①放热????反应物总能量高于生成物总能量
②
本题解析:
试题分析:(1)①由于反应物的总能量比生成物的总能量高,所以发生的反应Ⅰ是放热反应。② 由题目提供的能量关系可得该反应的热化学方程式为:Na(s)+1/4O2(g)=1/2Na2O(s) △H=-207 kJ/ mol。(2)反应Ⅱ是Na2O与水的反应,Na2O与水反应产生NaOH,反应的方程式为Na2O+H2O =2NaOH。NaOH的电子式为: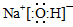 本题难度:一般
本题难度:一般
5、选择题 将含O2和CH4的混合气体充入装有23.4gNa2O2的密闭容器中点燃,反应结束后,容器温度为150℃,压强为0pa,将残留物溶于水无气体逸出。下列叙述正确的是(???)
A.原混合气体中O2和CH4的体积比为2:1
B.原混合气体中O2和CH4的体积比为1:3
C.残留固体中有Na2CO3和NaOH
D.残留固体中只有Na2CO3
参考答案:C
本题解析:依题意反应后容器温度为150℃,压强为0pa,知产物无气体和水。依据原子守恒推断产物应为Na2CO3和NaOH,配平如下:O2+ 2CH4+6Na2O2= 2Na2CO3+8NaOH(先根据碳原子和氢原子守恒配平),由方程式可知A、B、D均错误,故选C。
本题难度:一般