微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组离子能在溶液中大量共存的是
A.Na+、Mg2+、Cl-、OH-
B.H+、Ca2+、CO32-、NO3-
C.Cu2+、K+、SO42-、NO3-
D.Na+、H+、OH-、Ca2+
参考答案:C
本题解析:
试题分析:A、镁离子和氢氧根离子反应生成氢氧化镁沉淀,不能大量共存,错误;B、氢离子和碳酸根离子反应生成水和二氧化碳,不能大量共存,错误;C、四种离子都不发生离子反应,可以大量共存,正确;D、氢离子和氢氧根离子反应生成水,不能大量共存,错误,答案选C。
考点:考查离子大量共存的判断
本题难度:一般
2、选择题 某碱性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是(??? )
A.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈蓝色
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.在NaOH溶液中加入一定量的CH3COOH溶液,只有当溶液中离子浓度满足:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,才符合题意。
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
参考答案:B
本题解析:首先要强调隐含条件“碱性”,得出:c(OH-)>c(H+),再根据电荷守恒推出(Na+)>c(CH3COO-)。
A项恰好满足n(OH-)=n(H+),即酸和碱已电离出来的、H+、OH-恰好完全中和,但是由于醋酸是弱酸,大量的未电离,即大量剩余,故混合后溶液呈酸性。
B项是等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合,则恰好中和转化成为CH3COONa溶液,属于强碱弱酸盐溶液,故呈碱性,合乎题意。
C项中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,是满
本题难度:简单
3、选择题 在给定的条件下,下列各离子组能大量共存的是???????????( ????)
A.滴加酚酞试液显红色的溶液 Fe3+、NH4+、Cl-、SCN-
B.水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+
C.pH=12的溶液 K+、ClO-、NO3-、H+
D.pH=1的溶液 Cu2+、Na+、Mg2+、Cl-
参考答案:D
本题解析:
试题分析:A项中Fe3+、SCN-不能大量共存,B项中水电离出来的c(H+)=10-13mol/L的溶液,或呈酸性或呈强碱性,HCO3-不能大量共存,C项中pH=12的溶液是碱性溶液,H+不能大量共存。答案选D。
点评:离子不能大量共存的一般情况是:(1)能发生复分解反应的离子之间(即生成沉淀,气体,水、弱酸、弱碱等难电离物质);(2)能生成难溶物的离子之间(如:Ca2+和 SO42-;Ag+和 SO42-);(3)能完全水解的离子之间,如多元弱酸和弱碱盐的阴、阳离子(如:Al3+, Fe3
本题难度:一般
4、填空题 (15分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下还原法,在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
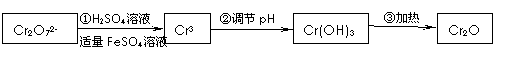
有关离子完全沉淀的pH如下表:
有关离子
| Fe2+
| Fe3+
| Cr3+
|
完全沉淀为对应氢氧化物的pH
| 9.0
| 3.2
| 5.6
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式 。
(2)还原+6价铬还可选用以下的 试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
在操作②中调节pH应分2次进行,第1次应先调节溶液的pH范围约在 (填序号)最佳,第2次应调节溶液的pH范围约在 (填序号)最佳
A.3~4 B.6~8 C.10~11 D.12~14
用于调节溶液的最佳试剂为: (填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
参考答案:(15分)(1)Cr2O72―+ 6 Fe2+ + 14H+
本题解析:略
本题难度:一般
5、选择题 25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.滴入石蕊试液显蓝色的溶液中:K+、Na-、HSO3-、ClO-
B.0.1mol?L-l的Fe(NO3)2溶液中:Na+、H+、SCN-、I-
C.0.1mol?L-l的NaAlO2溶液中:K+、H+、NO3-、SO42-
D.由水电离产生的c(H+)=1×10-13mol?L-l的溶液中:Na+、Ba2+、NO3-、Cl-
参考答案:D
本题解析:
试题分析:A、滴入石蕊试液显蓝色的溶液呈碱性,碱性溶液中OH—与HSO3-反应生成亚硫酸根和水,HSO3-和ClO-发生氧化还原反应生成硫酸根和氯离子,不能大量共存,错误;B、0.1mol?L-l的Fe(NO3)2溶液中H+、NO3-与I-发生氧化还原反应,不能大量共存,错误;C、0.1mol?L-l的NaAlO2溶液中,H+、AlO2—和水反应生成氢氧化铝沉淀,不能大量共存,错误;D、题给条件下,组内离子间不反应,能大量共存,正确。
考点:考查离子反应、离子共存问题。
本题难度:一般
|