微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把0.05 mol NaOH固体分别加入下列100 mL溶液中,溶液的导电性基本不变的是
A.自来水
B.0.5 mol/L盐酸
C.0.5 mol/L醋酸
D.0.5 mol/L mol·Lˉ1氨水
参考答案:B
本题解析:
试题分析:溶液的导电性与溶液中自由移动离子的浓度成正比,自由移动离子的浓度越大,溶液的导电性越强,若溶液的导电性变化不大,则自由移动离子的浓度变化不大,结合物质的反应特点解答该题;A、水是极弱电解质,所以自来水中自由移动离子浓度很小,向自来水中加入氢氧化钠固体,氢氧化钠是强电解质,完全电离,导致溶液中离子浓度增大,导电性显著增强,错误;B、盐酸是强酸,向溶液中加入氢氧化钠后,氢氧化钠和盐酸反应生成氯化钠和水,氯化钠是强电解质,离子浓度变化不大,溶液的导电性基本不变,正确;C、醋酸是弱电解质,氢氧化
本题难度:一般
2、选择题 已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:
NaCN+HNO2 HCN+NaNO2????NaCN+HF
HCN+NaNO2????NaCN+HF HCN+NaF??? NaNO2+HF
HCN+NaF??? NaNO2+HF HNO2+NaF
HNO2+NaF
由此可判断下列叙述不正确的是
A.K(HF)=7.2×10-4
B.K(HNO2)=4.9×10-10
C.根据两个反应即可得出结论
D.K(HCN)<K(HNO2)<K(HF)
参考答案:B
本题解析:
试题分析:根据较强的酸制备较弱的酸的原理可知,三种酸的酸性强弱顺序是HF>HNO2>HCN。因此亚硝酸的电离常数应该是4.6×10-4,选项B不正确,其余选项都是正确的,答案选B。
点评:本题是高考中的常见考点之一,该题的解题关键是掌握好“较强的酸制备较弱的酸的原理”,然后灵活运用即可。
本题难度:一般
3、选择题 已知一些银盐的颜色及溶解度数值如下:
化学式
| AgCl
| AgBr
| AgI
| Ag2S
| Ag2CrO4
|
颜色
| 白色
| 浅黄色
| 黄色
| 黑色
| 红色
|
溶解度/g
| 1.5×10-4
| 7.1×10-7
| 2.1×10-7
| 1.3×10-16
| 4.3×10-2
测定水体中氯化物的含量,常用标准硝酸银法进行滴定。滴定时,应加入的
指示剂是
A.KBr ?????????????B.KI???????? C.K2S ????????D.K2CrO4
参考答案:D
本题解析:使用铬酸钾做指示剂,只有当浓度比较大是才产生红色沉淀,说明氯离子沉淀完全。
本题难度:一般
4、选择题 50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=4的醋酸中:c(H+)=4.0mol?L-1
B.饱和小苏打溶液中:c(Na+)= c(HCO3-)
C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1
参考答案:C
本题解析:由溶液 pH计算表达式可得,c(H+)=10-pHmol/L,则pH=4的醋酸中c(H+)=10-4 mol?L-1,A项错误;小苏打的化学式是NaHCO3,属于钠盐、酸式盐,在水中能完全电离,即NaHCO3="=" Na++HCO3-,钠离子不能水解,而HCO3-不仅少部分水解生成碳酸,还有少部分HCO3-电离出碳酸根离子,即HCO3-+H2O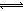 本题难度:一般 本题难度:一般
5、填空题 (共5分)今有a·盐酸、b·硫酸、 c·醋酸三种酸:(以下均用字母序号回答)
(1)在同体积,同pH的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是______________________。
(2)在同体积、同浓度的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是_______________________。
(3)当PH相同、体积也相同时,分别与过量同一浓度的NaOH溶液反应,消耗碱的体积由大到小的顺序为 。
(4)当PH相同时, 分别与等物质的量NaOH溶液反应, 消耗酸的体积由大到小的顺序为 。
(5)将PH相同的三种酸溶液均加水稀释至相同的PH时,则加水的体积由大到小的顺序为 。
参考答案:(5分)(1)c>a=b(1分) (2)b>a=c
本题解析:
试题分析:(1)醋酸是弱酸,在pH相等的条件下,醋酸的浓度最大,所以生成的气体最多,即c>a=b。
(2)硫酸是二元强酸,盐酸是一元强酸,所以在体积和浓度相等的条件下,硫酸生成的CO2最多,盐酸和醋酸相等,即b>a=c。
(3)在pH相等的条件下,醋酸的浓度最大,消耗的氢氧化钠最多,所以是c>a=b。
(4)在pH相等的条件下,醋酸的浓度最大,中和等量的氢氧化钠时,醋酸消耗的溶液体积最小,即a=b>c。
(5)醋酸在稀释过程中,会促进电离,氢离子的物质的量是增加的,所以将PH相同的三种酸溶液均加水稀释至相同的PH时,醋酸稀释的倍数最大,即c>a=b。
考点:考查弱电解质的电离平衡
点评:由于弱酸存在电离平衡,所以在判断该类试题时,需要注意的是所给的条件是pH相等,还是溶液的浓度相等,然后在依据条件逐一分析判断即可。
本题难度:困难
|