微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中正确的是(????)
A.中和热的热化学方程式2KOH(aq)+ H2SO4(aq)= K2SO4(aq)+2H2O(l)ΔH= -57.3 kJ/mo1
B.氢气燃烧热的热化学方程式:
C.H218O2中加入H2SO4酸化的KMnO4:5H2 18O2 + 2MnO4-+ 6H+ = 518O2↑+ 2Mn2+ + 8H2O
D.向CH2BrCOOH中加入足量的NaOH溶液并加热:CH2BrCOOH+OH- △———→CH2BrCOO-+ H2O
参考答案:C
本题解析:
试题分析:中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,所以选项A不正确,应该是KOH(aq)+1/2H2SO4(aq)=1/2K2SO4(aq)+2H2O(l)?? ΔH= -57.3 kJ/mo1;燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以选项B不正确,应该是H2 (g)+1/2O2 (g)=H2O(l)??△H=-241.8 kJ/mol;高锰酸钾能氧化双氧水,C正确;D不正确,在氢氧化钠溶液中加
本题难度:一般
2、填空题 (共10分)
(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。
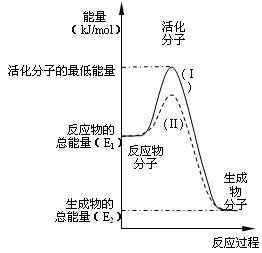
①图中所示反应是????????(填“吸热”或“放热”)反应,该反应??????(填“需要”、“不需要”或“不一定”)加热,该反应的△H =????????????(用含E1、E2的代数式表示)。
②对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是____________________________________。
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ ①C(s)+O2(g) === CO2(g) ΔH1<0
途径Ⅱ 先制水煤气:②C(s)+H2O(g) === CO(g)+H2(g) ΔH2>0
再燃烧水煤气:
③2CO(g)+O2(g) === 2CO2(g) ΔH3<0??????????④2H2(g)+O2(g) === 2H2O(g) ΔH4<0
请回答下列问题:
①判断两种途径放热:途径Ⅰ放出的热量________途径Ⅱ放出的热量(填“大于”、“等于”或“小于”)。
②ΔH1、ΔH2、ΔH3、ΔH4的数学关系是_________________________________。
③由于制取水煤气的反应里,反应物具有的总能量________(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要________能量才能转化为生成物,因此其反应条件为________。
(3)已知:Fe2O3(s)+3CO(g) === 2Fe(s)+3CO2(g)?? ΔH1=-25 kJ·mol-1??????①
3Fe2O3(s)+CO(g) === 2Fe3O4(s)+CO2(g)??ΔH2=-47 kJ·mol-1???②
Fe3O4(s)+CO(g) === 3FeO(s)+CO2(g)???ΔH3=+19 kJ·mol-1?????③
请写出CO还原FeO的热化学方程式:______________________________________。
参考答案:(1)①放热;?????不一定;???? - (E1 - E
本题解析:(1)①由图可知,反应物的总能量高于生成物的总能量,所以为放热反应,反应的△H = —(E1 - E2) kJ·mol-1,至于是否需要加热,不可而知;
②使用了催化剂,可使活化能大大降低,活化分子百分数增多,反应速率加快
(2)本题可用盖斯定律进行解释。途径I可看作是途径II的总反应,即①=②+(③+④)/2;
(3)同样依据盖斯定律:(①×3-②-③×2)/6可得到:FeO(s)+CO(g)==Fe(s)+CO2(g)??ΔH =-11 kJ·mol-1
本题难度:一般
3、选择题 下列变化属于吸热反应的是
①用镁条引燃铝、氧化铁混合粉末???②碳酸钙受热分解???③浓硫酸稀释?
④氢氧化钡晶体和氯化铵固体反应???⑤生石灰和水反应
A.②④
B.①④
C.②③
D.①⑤
参考答案:A
本题解析:①③⑤放热反应,②④吸热反应,强酸强碱溶于水放热,铝热反应放出大量的热。
本题难度:一般
4、选择题 共价键都有键能之说,键能是指拆开1mol共价键需要吸收的能量或者形成1mol共价键所放出的能量.如H-H键的键能是436kJ/mol,H-Cl键的键能是431kJ/mol,Cl-Cl键的键能是247kJ/mol,H2和Cl2反应生成1molHCl放出的热量是( )
A.431kJ
B.179kJ
C.89.5kJ
D.以上说法都不对
参考答案:在反应H2+Cl2
本题解析:
本题难度:一般
5、选择题 下列对“改变反应条件,导致化学反应速率改变”的原因描述不正确的是(??? )
A.增大反应物的浓度,活化分子百分数增加,反应速率加快?
B.增大气体反应体系的压强,单位体积中活化分子数增多,气体反应速率加快
C.升高反应的温度,活化分子百分数增加,有效碰撞的几率提高,反应速率增大
D.催化剂通过改变反应路径,使反应所需的活化能降低,反应速率增大
参考答案:A
本题解析:增大反应物的浓度,可以增加单位体积内活化分子百分数,所以反应速率加快,因此选项A是不正确的,其余选项都是正确的,答案选A。
本题难度:一般