微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(溶液)  H+(溶液)+In-(溶液)
H+(溶液)+In-(溶液)
红色???????????????????????黄色
浓度为0.02 mol·L-1的下列各溶液:①盐酸②石灰水③NaCl溶液?④NaHSO4溶液?⑤NaHCO3溶液?⑥氨水,其中能使指示剂显红色的是(???)
A.①④⑤
B.②⑤⑥
C.①④
D.②③⑥
参考答案:C
本题解析:根据方程式可知,要使指示剂显红色,则平衡应该向逆反应方向进行。所以根据方程式可知,增大氢离子浓度可以使平衡向逆反应方向进行,溶液显红色,答案选C。
本题难度:一般
2、填空题 (10分)(1)现有NH4Cl和NH3·H2O组成的混合溶液,若其pH=7,则该溶液中c(NH4+)___c(Cl-);若pH>7,则该溶液中c(NH4+)______c(Cl-)。(填“>”、“<”、“=”).
(2)0.1mol/L的NaHCO3溶液中,按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外) ,c(Na+)+c(H+)=_______________ ,c(Na+)=____________
参考答案:(1) 本题解析:
本题解析:
试题分析:(1)氯化铵和氨水的混合溶液,若pH=7,说明溶液为中性,即氢离子浓度=氢氧根离子浓度,根据电荷守恒,则铵根离子浓度=氯离子浓度。若pH>7,溶液为碱性,即氢离子浓度<氢氧根离子浓度,根据电荷守恒知铵根离子浓度大于氯离子浓度。(2)碳酸氢钠溶液中存在碳酸氢根电离和水解,水解大于电离,所以离子浓度大小顺序为: c(Na+)> c(HCO3-)> c(OH-)> c(H2CO3)> c(H+)> c(CO32-)。根据电荷守恒知道:c(Na+)+ c(H+)= c(HCO3-)+ c(OH-)+2 c(CO32-),根据物料守恒,即c(Na+)= c(HCO3-)+c(H2CO3)+ c(CO32-)。
考点:溶液中的离子浓度关系。
本题难度:一般
3、填空题 (12分)Ⅰ.(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 ________(填“促进”、“抑制”)其水解。
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
Ⅱ. 已知水在25 ℃(A)和T ℃(B)时,其电离平衡曲线如图所示:
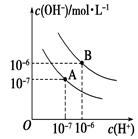
(1)25 ℃时,将pH=3 的H2SO4溶液与pH=10的NaOH溶液混合,若所得混合溶液的pH=7,则H2SO4溶液与NaOH溶液的体积比为 。
(2)T ℃时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强Ⅰ碱的pH2之间应满足的关系是 。
(3)曲线B对应温度下,pH=3的HCl溶液和pH=9的某碱溶液等体积混合后,混合溶液的pH>7。请分析其原因: 。
参考答案:Ⅰ .(1)酸,< ,Ag++H2O  本题解析:
本题解析:
试题分析:Ⅰ.(1)AgNO3是强酸弱碱盐,弱碱根离子水解消耗水电离产生的OH-,使盐的水溶液呈酸性。常温时的pH<7。水解的两种方程式是Ag++H2O  AgOH+H+。实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解。(2)硫化钠是强碱弱酸盐,弱酸根离子水解消耗水电离产生的H+,使溶液显碱性。在配制硫化钠溶液时,为了防止发生水解,可以加入少量的NaOH溶液。Ⅱ. (1) 25 ℃时H2SO4是强酸,pH=3,c(H+)=10-3mol/L;pH=10的NaOH,c(H+)=10-10mol/L;由于在25 ℃时Kw=10-14,所以c(OH-)=10-4mol/L. 由于所得混合溶液的pH=7,所以V(酸) ·c(H+)= V(碱) ·c(OH-);所以V(酸) :V(碱) = c(OH-):c(H+)=10-4mol/L:10-3mol/L=1:10;(2)在T ℃时Kw=10-12. 10体积pH1=a的溶液V(酸) ·c(H+)=10×10-a=10(1-a); 1体积pH2=b的某强碱, V(碱) ·c(OH-)=1×10-12÷10-b=10(b-12).由于混合后溶液呈中性,所以10(1-a)=10(b-12)。所以a+b=13或pH1+pH2=13。(3)在曲线B对应温度下,Kw=10-12.pH=3的HCl溶液c(H+)=10-3mol/L, pH=9的某碱溶液c(OH-)=10-12÷10-9mol/L=10-3mol/L,等体积混合后,若该碱为强碱,则恰好中和,混合溶液的pH=7。但是现在溶液的pH>7,说明碱过量。该碱为弱碱,在溶液中存在大量的弱碱分子。电离的部分恰好与酸中和,由于破坏了弱碱的电离平衡,碱会继续电离出OH-,使溶液呈碱性。
AgOH+H+。实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解。(2)硫化钠是强碱弱酸盐,弱酸根离子水解消耗水电离产生的H+,使溶液显碱性。在配制硫化钠溶液时,为了防止发生水解,可以加入少量的NaOH溶液。Ⅱ. (1) 25 ℃时H2SO4是强酸,pH=3,c(H+)=10-3mol/L;pH=10的NaOH,c(H+)=10-10mol/L;由于在25 ℃时Kw=10-14,所以c(OH-)=10-4mol/L. 由于所得混合溶液的pH=7,所以V(酸) ·c(H+)= V(碱) ·c(OH-);所以V(酸) :V(碱) = c(OH-):c(H+)=10-4mol/L:10-3mol/L=1:10;(2)在T ℃时Kw=10-12. 10体积pH1=a的溶液V(酸) ·c(H+)=10×10-a=10(1-a); 1体积pH2=b的某强碱, V(碱) ·c(OH-)=1×10-12÷10-b=10(b-12).由于混合后溶液呈中性,所以10(1-a)=10(b-12)。所以a+b=13或pH1+pH2=13。(3)在曲线B对应温度下,Kw=10-12.pH=3的HCl溶液c(H+)=10-3mol/L, pH=9的某碱溶液c(OH-)=10-12÷10-9mol/L=10-3mol/L,等体积混合后,若该碱为强碱,则恰好中和,混合溶液的pH=7。但是现在溶液的pH>7,说明碱过量。该碱为弱碱,在溶液中存在大量的弱碱分子。电离的部分恰好与酸中和,由于破坏了弱碱的电离平衡,碱会继续电离出OH-,使溶液呈碱性。
考点:考查盐的水解平衡、弱电解质的电离平衡、酸碱溶液混合时溶液的pH的计算的知识.
本题难度:困难
4、选择题 下列叙述不正确的是
A.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B.一定温度下,1 L1 mol/L的氨水与2 L0.5 mol/L的氨水中,n(NH4+)前者多
C.相同体积、相同物质的量浓度的盐酸、醋酸,稀释相同倍数后,溶液的pH:盐酸<醋酸
D.0.2 mol/L的一元酸HX与0.1 mol/L的KOH溶液等体积混合所得溶液中,一定有:a(H+)+c(K+)=c(OH-)+c(X-)
参考答案:B
本题解析:
本题难度:一般
5、选择题 现有常温下的四份溶液:①0.01mol/LCH3COOH ②0.01mol/LHCl ③pH=12的氨水④pH=12的? NaOH溶液下列说法正确的是
A.①中水电离程度最小,③中水电离程度最大
B.将②③混合,若pH=7,则消耗溶液的体积:②﹥③
C.将四份溶液稀释相同倍数后,溶液的pH:③﹥④,②﹥①
D.将①、④混合,若有c(CH3COO-)﹥c(H+),则混合液一定呈碱性
参考答案:B
本题解析:酸或碱氢离子或OH-浓度越大,对水的抑制程度越大,所以②③④对水的抑制程度相同,①最小,A不正确。氨水是弱碱,其浓度大于0.01mol/L,所以消耗的盐酸多,B正确。稀释促进电离,因此将四份溶液稀释相同倍数后,溶液的pH是③﹥④,②<①,C不正确。选项D中c(CH3COO-)﹥c(H+),但OH-浓度不一定大于氢离子的,D不正确,答案选B。
本题难度:一般