微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 肼(N2H4)分子中所有原子均达到稀有气体原子的稳定结构,它的沸点高达113℃,燃烧热为642 kJ·mol-1,肼与氧气及氢氧化钾溶液还可构成燃料电池。已知肼的球棍模型如图所示,下列有关说法正确的是(??)

A.肼是由极性键和非极性键构成的非极性分子
B.肼沸点高达l13℃,可推测肼分子间能形成氢键
C.肼燃烧的热化学方程式为:N2H4(g)+ O2(g) = N2(g) +2H2O(g);△H = -642 kJ·mol-1
D.肼-氧气燃料电池,负极的电极反应为:O2 +2H2O+4e-=4OH-
参考答案:B
本题解析:
正确答案:B
A、不正确,肼是由极性键和非极性键构成的极性分子
B.正确,肼沸点高达l13℃,分子间作用力大,可推测肼分子间能形成氢键
C.不正确,肼燃烧的热化学方程式为:N2H4(l)+ O2(g) = N2(g) +2H2O(l);△H = -642 kJ·mol-1
D.不正确,肼-氧气燃料电池,正极的电极反应为:O2 +2H2O+4e-=4OH-
本题难度:简单
2、填空题 下列物质中:(1)互为同分异构体的有?????(2)互为同素异形体的有?????
(3)属于同位素的有??????(填序号)
①液氯②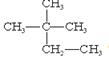 ③白磷④氯气⑤
③白磷④氯气⑤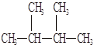 ⑥
⑥ Cl? ⑦
Cl? ⑦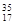 Cl?⑧红磷
Cl?⑧红磷
参考答案:(1)②⑤(2)③⑧(3)⑥⑦
本题解析:
试题分析:(1)分子式相同结构不同的化合物互为同分异构体,所以根据有机物的结构简式可知,互为同分异构体的是②⑤。
(2)由同一种元素形成的不同单质互为同素异形体,则互为同素异形体的是③⑧。
(3)质子数相同,中子数不同的同一种元素的不同核素互称为同位素,所以互为同位素的是⑥⑦。
点评:该题是常识性知识的考查,难度不大。该题的关键是明确同分异构体、同素异形体和同位素的含义以及判断依据,然后结合题意灵活运用即可。
本题难度:一般
3、填空题 在一定条件下,乙烷和乙烯都能制备氯乙烷(C2H5Cl)。试回答:
(1)用乙烷制备氯乙烷的化学方程式是_____________________,反应类型是_____________;
(2)用乙烯制备氯乙烷的化学方程式是_____________________,反应类型是_____________;
(3)上述两种制备乙烷的方法中,_____方法好(填1或2)。原因是____________________。
参考答案:(1)C2H6+Cl2![]() 本题解析:
本题解析:
本题难度:一般
4、选择题 ①丁烷②2-甲基丙烷③戊烷④2-甲基丁烷⑤2,2-二甲基丙烷,物质的沸点排列顺序正确的是 [???? ]
A.①>②>③>④>⑤
B.⑤>④>③>②>①
C.③>④>⑤>①>②
D.②>①>⑤>④>③
参考答案:C
本题解析:
本题难度:一般
5、填空题 在常温下的密闭容器中充入一定量的CH4、O2和足量Na2O2,用电火花不断引燃,待反应完全后,恢复到原温度,容器内压强几乎为0。求:
(1)容器内CH4和O2的物质的量之比应为__________。
(2)若容器中Na2O2的质量为23.4 g,则容器中O2的质量m的范围为__________。
参考答案:(1)2∶1?(2)m≤1.6 g
本题解析:(1)容器内压强几乎为0,即无气体剩余,则所有元素以固体形式存在,根据质量守恒知,固体产物为Na2CO3和NaOH,故有关系式:6Na2O2+2CH4+O2====2Na2CO3+8NaOH。
(2)要保证气体全部被吸收,Na2O2必须过量
6Na2O2???—??? O2
6????????????? 1
0.3??????????? n(O2)
n(O2)<0.05 mol
即m(O2)<32 g·mol-1×0.05 mol="1.6" g
本题难度:简单