微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 工业上用铝土矿(主要成分是A1203,还有少量的Fe203,SiO2)提取冶炼铝的原料氧化铝.工艺流程图如图:
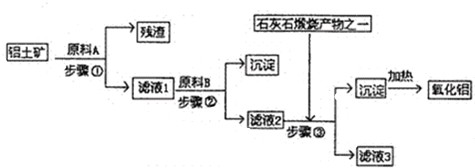
(1)原料A的名称是______,步骤①反应的离子方程式是______.
(2)滤液1中要加入稍过量原料B,原料B的化学式是______.步骤②反应的离子方程式是:______.
(3)步骤③的离子化学方程式是:______.
(4)步骤①②③的操作都是______(填操作名称),要检验Al(OH)?3沉淀是否完全的方法是______.
(5)如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响?______.
参考答案:由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,
本题解析:
本题难度:一般
2、填空题 分某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验:
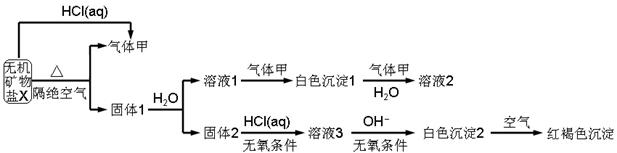
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1.请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______,写出气体甲的电子式_______。
(2)X的化学式是______,在惰性气流中加热X至完全分解的化学反应方程式为_______。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。
(4)一定条件下,气体甲鱼固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式_______,并设计实验方案验证该反应的产物_______。
参考答案:(1) 本题解析:
本题解析:
试题分析:白色沉淀2在空气中变成红褐色沉淀说明白色沉淀2是Fe(OH)2。溶液1中通入甲气体,有白色沉淀1,再通入甲气体(注意:水存在时)又溶解,甲气体是弱酸性气体,根据X与固体1的质量确定是CO2。
本题难度:一般
3、选择题 下列关于Fe2+和Fe3+的叙述中。错误的是
A.Fe2+的水溶液为浅绿色
B.Fe3+的水溶液为黄色
C.Fe3+具有氧化性,Fe2+具有还原性
D.Fe3+溶液中滴入含SCN-的溶液,立即出现红色沉淀
参考答案:D
本题解析:
试题分析:A、Fe2+的水溶液为浅绿色,A正确;B、Fe3+的水溶液为黄色,B正确;C、Fe3+中铁元素是+3价,具有氧化性,Fe2+中铁元素是+2价,具有还原性,C正确;D、Fe3+溶液中滴入含SCN-的溶液,溶液立即显红色,而不是出现红色沉淀,D不正确,答案选D。
本题难度:一般
4、计算题 在铁和氧化铁的混合物15g中加入150mL稀H2SO4放出氢气1.68L(标准状况)。当反应停止后,铁和氧化铁均无剩余,且溶液中无Fe3+存在。为了中和过量H2SO4,并使Fe2+完全转化为Fe(OH)2沉淀,共耗用3 mol/L NaOH溶液200mL。求:
①混合物中铁和氧化铁各多少克?
②稀H2SO4的物质的量浓度为多少?
参考答案:(1)混合物中铁是7g,氧化铁是8g。(2)稀H2SO4的物
本题解析:(1)设铁和氧化铁的物质的量分别为x和y,则
x×56g/mol+y×160 g/mol=15g……………①
由得失电子守恒得,x×2=y×2+1.68L/22.4L/mol×2……………②
解得:x=0.25mol, y=0.05mol.即m(Fe)=0.25mol×56g/mol=7g, m(Fe2O3)=0.05mo l×160g/mol=8g
(2)在铁和氧化铁的混合物中加入稀H2SO4反应停止后,溶液中的溶质主要是H2SO4和FeSO4。
由电荷守恒知:硫酸中的硫酸
本题难度:简单
5、选择题 某含铬Cr2O72-废水用硫酸亚铁铵[FeSO4·(NH4)2 SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n molFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是?????????????(???)
A.消耗硫酸亚铁铵的物质量为n(2-x)mol
B.处理废水中Cr2O72-的物质量为mol
C.反应中发生转移的电子数为3nx mol
D.在FeO·FeyCrxO3中3x=y
参考答案:A
本题解析:A项:消耗硫酸亚铁铵的物质的量为n(y+1),又由FeO·FeyCrxO3电中性知3x+3y=6,代入前式得,消耗硫酸亚铁铵的物质的量为n(3-x);
B项:Cr元素nxmol,故Cr2O72-的物质的量为nx/2;
C项:得到nmolFeO·FeyCrxO3,则一共有nx molCr参加反应,1molCr转移电子3mol,且仅Cr失电子,故转移的电子数为3nxmol;
D项:FeO·FeyCrxO3中,Fe为正三价,由得失电子守恒知3x-y=0,即3x=y
故选A。
本题难度:一般