微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用NA表示阿伏加德罗常数,下列说法正确的是(??)
A.0.1mol的Na2O2中含阴离子数是2NA
B.14g乙烯和丙烯的混合物中含有的碳原子数为NA
C.1mol的溴乙烷中含有NA个Br?-
D.1mol乙酸和1mol无水乙醇反应生成的乙酸乙酯分子为NA
参考答案:B
本题解析:过氧化钠的电子式为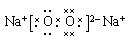 ,所以阳离子和阴离子的个数之比是2︰1,A不正确。乙烯和丙烯的最简式相同,都是CH2,所以选项B正确。溴乙烷是非电解质,属于共价化合物,不含溴离子,C不正确。酯化反应是可逆反应,选项D中不可能生成1mol乙酸乙酯,不正确。答案选B。
,所以阳离子和阴离子的个数之比是2︰1,A不正确。乙烯和丙烯的最简式相同,都是CH2,所以选项B正确。溴乙烷是非电解质,属于共价化合物,不含溴离子,C不正确。酯化反应是可逆反应,选项D中不可能生成1mol乙酸乙酯,不正确。答案选B。
本题难度:一般
2、选择题 以NA表示阿伏加德罗常数的值,下列说法正确的是(??? )
A.0.1mol Fe与足量盐酸反应,转移的电子数为0.3NA
B.28gCO中所含的原子数为2NA
C.1L 0.1mol/LNa2CO3溶液中,含有CO32— 数为0.1NA
D.22.4LH2的分子数为NA
参考答案:B
本题解析:
试题分析:铁与盐酸反应生成二价铁,所以0.1mol Fe反应转移0.2NA 个电子,A错误;28gCO为1mol,而CO是双原子分子,所以含有原子数为2 NA ,故B正确;Na2CO3溶液中的CO32— 发生水解,所以含有CO32— 数小于0.1NA ,C错误;D项中的氢气没有给出条件,所以无法计算数目,D错误;故选B。
本题难度:一般
3、选择题 将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O、NO+NO2+2NaOH=2NaNO2+H2O。则生成的盐溶液中NaNO3的物质的量为( )
A.0.2 mol
B.0.4 mol
C.0.6 mol
D.0.8 mol
参考答案:A
本题解析:
试题分析:n(Cu)=" 51.2" g÷64g/mol=0.8mol.Cu失去电子的物质的量是0.8×2="1.6mol." 硝酸得到电子产生氮的氧化物(含NO、N2O4、NO2)的混合物共0.8 mol,,n(NaOH)=1mol.由于氮的氧化物都转化为NaNO3或NaNO2.n(N)n(Na)=1:1,所以n(N2O4)=0.2mol;n(NO+NO2)=0.6mol..假设收集到氮的氧化物(含NO、N2O4、NO2)的混合物0.8 mol,含有二氧化氮的物质的量为a ,一氧化氮的物质的量为(0.6-a)mol, n(N2O4)=0.2mol.根据电子守恒可得:1×a+3×(0.6-a)+2×0.2=1.6.解得a=0.3mol.因为N2O4 2NO2.
2NO2.
收集到氮氧化物也就相当于是n(NO2)=0.3+2×0.2=0.7mol.,n(NO)=0.3mol.。结合两个方程式可知发生第二个反应的二氧化氮、一氧化氮的物质的量都是0.3mol,发生第一个反应的二氧化氮物质的量为0.4mol.所以产生NaNO30.2mol, 产生NaNO20.2mol+0.3mol="0.8mol."
考点:考查Cu与适量浓硝酸反应产物的知识。
本题难度:一般
4、简答题 在实验室中常用HNO3的质量分数为65%,密度为1.4g?cm-3的浓硝酸,计算(保留3位有效数字):
(1)此浓硝酸中HNO3的物质的量浓度.
(2)配制100mL?3.0mol/L的硝酸,所需浓硝酸的体积.
参考答案:(1)C=1000
本题解析:
本题难度:一般
5、选择题 对于相同条件下相同物质的量的O2和O3,下列说法中正确的是( )
A.体积之比为1:1
B.原子总数之比为2:3
C.原子总数之比为1:1
D.体积之比为2:3
参考答案:A、相同条件下相同物质的量的O2和O3,体积之比等于物质的量
本题解析:
本题难度:简单