微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 标准状况下,往100 mL 0.1 mol·L-1的FeBr2溶液中通入一定体积的Cl2,充分反应后,溶液中有50%的Br-被氧化。则通入的氯气的体积是( )
A.0.224 L
B.0.336 L
C.0.448 L
D.0.672 L
参考答案:A
本题解析:
试题分析:Fe2+的还原性强于Br-,所以Cl2先氧化Fe2+,再氧化Br-。溶液中有50%的Br-被氧化时则Fe2+完全被氧化。失电子数为0.01mol+0.02mol×50%=0.02mol,所以得电子数为0.02mol,氯气的物质的量为0.01mol,氯气的体积为0.224 L。
考点:氧化还原反应
点评:本题根据得失电子数相等计算。
本题难度:一般
2、填空题 写出下列物质的电子式:
(1)MgCl2??????????(2) CO2??????????(3)NaOH??????????(4) H2O2????????
参考答案:(1) 本题解析:考查常见物质电子式的书写。书写电子式首先要判断化学键类型,然后再书写,氯化镁是含有离子键的离子化合物,CO2是含有极性键的共价化合物,氢氧化钠是含有离子键和极性键的离子化合物,双氧水是含有极性键和非极性键的共价化合物。
本题解析:考查常见物质电子式的书写。书写电子式首先要判断化学键类型,然后再书写,氯化镁是含有离子键的离子化合物,CO2是含有极性键的共价化合物,氢氧化钠是含有离子键和极性键的离子化合物,双氧水是含有极性键和非极性键的共价化合物。
本题难度:简单
3、简答题 现有三种常见治疗胃病药品的标签:

这三种药品中所含的物质均能中和胃里过量的盐酸.
(1)某患者服用①药片2片后发生打嗝现象,请计算该患者服用该药片2片产生气体体积多少mL.(体积按标准状况计)
(2)若按每片药片中和胃酸的量来衡量药效,则每服用药片③1片,相当于服用药片②多少片.(精确到小数点后面一位)
参考答案:(1)2片①药片含有CaCO3的质量为500mg,即0.5g
本题解析:
本题难度:一般
4、填空题 (7分)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)
(1)硝酸在该反应中表现出的性质是_____________________。
(2)0.4molCu被硝酸完全溶解后,硝酸得到的电子数是________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是________mol。
(3)0.3molCu被另一浓度的硝酸完全溶解后,如果此时产生的NO和NO2气体总体积在标准状况下为8.96 L,则被还原的硝酸的物质的量是_______mol,参加反应的硝酸的物质的量是______mol,产生的混合气体中NO和NO2体积比为_______。
参考答案:(1)酸性和氧化性;(2)0.8NA;1.2mol ;(3)
本题解析:
试题分析:(1)根据反应方程式,HNO3转成了氮的氧化物、硝酸铜中的硝酸根,硝酸表现出的性质是:氧化性、酸性;(2)根据得失电子数目守恒,铜失去的电子数等于硝酸得到的电子数,0.4×2×NA=0.8NA;参加反应的硝酸转变成硝酸铜中的硝酸根和氮的氧化物,根据得失电子数目守恒:0.4×2=n(NO)×3+n(NO2)×1求得:n(NO)=n(NO2)=0.2mol,根据氮元素守恒:n(HNO3)=2n[Cu(NO3)2]+n(NO)+n(NO2)=2×0.3+0.4=1mol;(3)硝酸被还原后转成了NO和NO2,根据氮元素守恒,被还原硝酸的物质的量=n(NO)+n(NO2)=8.96/22.4mol=0.4mol,根据(2)的分析参加反应的硝酸的物质的量=2n[Cu(NO3)2]+n(NO)+n(NO2)=2×0.3+0.4=1mol,根据题意:n(NO)+n(NO2)=8.96/22.4,得失电子数目守恒2×0.3=n(NO)×3+n(NO2),解得:n(NO)=0.1mol,n(NO2)=0.3,体积比=1:3。
考点:考查氧化还原反应、化学计算等知识。
本题难度:一般
5、填空题 (14)A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如图所示:
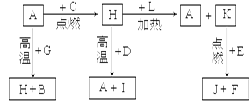
请回答下列问题:
(1)元素A在元素周期表中的位置为??????周期??????族。
(2)写出K的电子式?????????。
(3)写出H和D反应的化学方程式??????????????????。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式?????????????。
(5)写出A与G反应的化学方程式???????????????????????。
(6)K与E反应时产生的现象有????????????;该反应的化学方程式为????? ___________________。
(7)已知F的燃烧热为akJ/mol,L的燃烧热为bkJ/mol,试写出F生成L的热化学方程式_________________
参考答案:(1)四;VIII ;(2) 本题解析:
本题解析:
试题分析:根据题意及物质间的转化关系可得:A是Fe;B是H2;C是O2;D是Al;E是Mg;F是C;G是H2O;H是Fe3O4;I是Al2O3;J是MgO;K是CO2;L是CO。(1)26号元素Fe在元素周期表中位于第四周期第VIII族;(2)CO2的电子式是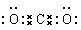 ;(3)Fe3O4和Al发生铝热反应的化学反
;(3)Fe3O4和Al发生铝热反应的化学反
本题难度:一般