微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下表为元素周期表的一部分,请回答:
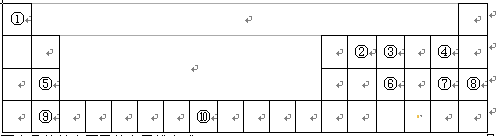
(1)写出⑩的基态原子的电子排布式:????????????????????????。
(2)第一电离能:⑤???????⑨(填“ > ”、“ < ”或“ = ”)
(3)①~⑩元素中,电负性最大的是??????(填元素符号,下同),第一电离能最大的是?????????。
(4)③、⑥分别形成的气态氢化物,稳定性较强的是????????????(填化学式,下同),沸点较高的是??????,原因:??????????????????????????????????????。
(5)①与②形成的化合物,其VSEPR模型为???????????;中心原子的杂化方式为
?????杂化;该分子为?????????分子(填“极性”或“非极性”)。
参考答案:(1) 本题解析:
本题解析:
本题难度:一般
2、填空题 (13分)右图是元素周期表的另一种画法——三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置。回答下列问题:
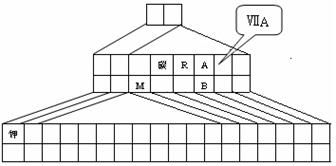
⑴请在右图中将过渡元素所在的位置“用斜线”画出。
⑵R的第一电离能????A的第一电离能(填大于、小于或等于);写出铷元素原子的外围电子排布式?????????????;
⑶R的氢化物在A的氢化物中溶解度极大,原因是???????????????????????????????;
A的氢化物比B的氢化物热稳定性强,原因是????????????????????????????????????。
⑷图中A、B两元素形成的离子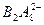 中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。该离子可能具有的化学性质是_________,依据是_______________________________。
中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。该离子可能具有的化学性质是_________,依据是_______________________________。
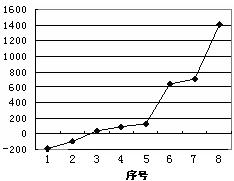
⑸第三周期8种元素按单质熔点(℃)高低的顺序如右图,(已知序号“1”代表Ar),其中序号 “8”代表??????(填元素符号);其中电负性最大的是?????(填下图中的序号)。
⑹C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键的原因
_______________________________________________________________
参考答案:(共13分)(原理解释2分,其余每空1分)
(1)略<
本题解析:
本题难度:一般
3、填空题 W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y。W原子的最外层没有p电子,X原子核外s电子与p电子数之比为1∶1,Y原子最外层s电子与p电子数之比为1∶1,Z原子核外电子中p电子数比Y原子多2个。
(1)X元素的单质与Z、Y所形成的化合物反应,其化学方程式:________________________。
(2)W、X元素的最高价氧化物对应水化物的碱性强弱为__________<__________(用分子式表示)。
(3)这四种元素原子半径的大小为__________>__________>__________>__________(填元素符号)。
参考答案:(1)2Mg+CO2 本题解析:
本题解析:
本题难度:一般
4、选择题 X元素气态氢化物为XH3,它的最高氧化物对应的水化物为
A.HX O4
B.H2X O4
C.H3X O4
D.H4X O4
参考答案:C
本题解析:
本题难度:一般
5、选择题 某元素R的最高价氧化物化学式为R2O5,又知R的气态氢化物中含氢8.8%,则R的相对原子质量为( )
A.28
B.14
C.16
D.31
参考答案:D
本题解析:
本题难度:一般