微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中,各组离子一定能大量共存的是???????????????????????????????????????????????????????(???)
A.在强酸性溶液中:K+、NH4+、SO42—、C1O—
B.能使石蕊试液呈蓝色的溶液中:Na+、I—、CI—、NO3—
C.在pH=l的溶液中:NH4+、Mg2+、SO32—、NO3—
D.含有大量Al3+的溶液中:NH4+、Na+、Cl—、HCO3—
参考答案:B
本题解析:略
本题难度:一般
2、填空题 (14分)现有五种可溶性物质A、B、C、D、E, 它们所含的阴、阳离子互不相同,分别含有五种阳离子 Na+、Al3+、Mg2+、Ba2+、Fe3+ 和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是
和 (填化学式,且相对分子质量小的写在第一个空);
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕黄色沉淀(红白混合颜色),向该沉淀中滴人稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解。则X为 ;
A.SO32- B.SO42- C.CH3COO- D.SiO32-
(3)B的水溶液不显中性,原因为 (用离子方程式表示);
(4)将0. 02 molA与0.0 1molC同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为
(保留两位有效数字);
(5)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的 (填相应的离子符号)。有关反应的离子方程式为: ;
(6)利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论 。
参考答案:(1)Na2CO3、Ba(OH)2 (
本题解析:
试题分析:(1)碳酸根离子只能与钠离子结合,因此一定含有碳酸钠。此时氢氧根离子只能与钡离子结合,所以一定还含有氢氧化钡。
(2)当C与B的溶液混合时,产生红褐色沉淀和无色无味气体,红褐色沉淀是氢氧化铁,无色无味的气体一定是CO2,所以B是碳酸钠,C中含有铁离子;当C与A的溶液混合时产生棕黄色沉淀(红白混合颜色),向该沉淀中滴入稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解,这说明A是氢氧化钡,C中还含有硫酸根,因此C是硫酸铁,答案选B。
(3)碳酸钠是强碱弱酸盐,碳酸根水解溶液显碱性,方程式为CO32-+ H2O 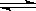 HCO3— + OH-;
HCO3— + OH-;
(4)0.02mol氢氧化钡与0.01mol硫酸铁混合生成0.02mol硫酸钡和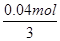 氢氧化铁,其质量是0.02mol×233g/mol+
氢氧化铁,其质量是0.02mol×233g/mol+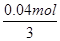 ×107g/mol=6.1g;
×107g/mol=6.1g;
(5)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,红棕色气体是NO2,这说明D中含有硝酸根。在酸性条件下硝酸根能氧化金属铜,反应的离子方程式为3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O;
(6)D中含有硝酸根离子,E中含有氯离子,而剩余的阳离子只有铝离子和镁离子,则检验出D、E中的阳离子的实验操作是:往D的溶液中逐渐加入Ba(OH)2溶液直至过量,若先出现白色沉淀后又逐渐溶解,则D中含有Al3+,E中含有Mg2+。或:往D的溶液中加入适量Na2CO3溶液,若产生了白色沉淀和无色无味的气体,则D中含有Al3+,E中含有Mg2+。
考点:考查离子共存和离子检验的有关分析与计算
本题难度:困难
3、选择题 在水电离出的C(H+)=10-14mol/L的溶液中,一定能大量共存的离子组是
A.K+、Na+、HCO3-、Cl-
B.K+、AlO2-、Br-、Cl-
C.Na+、Cl-、NO3-、SO42-
D.Al3+、NH4+、Cl-、SO42-
参考答案:C
本题解析:略
本题难度:简单
4、选择题 某无色透明的溶液,一定能大量共存的离子组是???????????[???? ]
A.Cl-、SO42-、Na+、K+???????????????
B.K+、CO32-、Ca2+、NO3-
C.HCO3-、Na+、NO3-、H+?????????????
D.NO3-、Cu2+、Cl-、NH4+
参考答案:A
本题解析:
本题难度:一般
5、选择题 一定能在下列溶液中大量共存的离子组是
A.水电离产生的H+浓度为1×10-12mol·L-1的溶液:NH4+.Na+.Cl-.HCO3-
B.含有大量Fe3+的溶液:SCN-.I-.K+.Br-
C.能使pH试纸变蓝色的溶液:Na+.AlO2-.S2-.CO32-
D.澄清透明的无色溶液:ClO-.MnO4-.Al3+.SO42-
参考答案:C
本题解析:
试题分析:A项水电离产生的H+浓度为1×10-12mol·L-1,说明水的电离受到了抑制,是酸溶液或碱溶液,NH4+不能在碱溶液中存在,HCO3-不能在酸或碱中存在;B项含有Fe3+的溶液不能与SCN-共存,生成硫氰化铁溶液,与I-会发生氧化还原反应,也不能共存;C项能使pH试纸变蓝色的溶液显碱性,离子能大量共存;D项MnO4-是紫色的。
点评:总结无色溶液则不存在有色的Cu2+、MnO4-、Fe3+、Fe2+等离子。
本题难度:简单