微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如右
图所示。则下列说法不正确的是
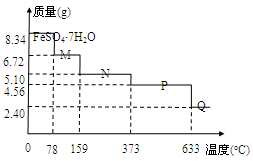
A.在100℃时,M的化学式为FeSO4·4H2O
B.FeSO4·7H2O晶体中有4种不同结合力的水分子
C.FeSO4·H2O存在的最高温度为373℃
D.380℃的P加热至650℃时的化学方程式为:2FeSO4 Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
参考答案:B
本题解析:
试题分析:8.34 g FeSO4·7H2O 的物质的量是0.03mol。A、在100℃时,M的质量为6.72g,减少了1.62g水,剩余0.12mol的水,所以FeSO4与H2O的物质的量比是1:4,正确;B、晶体中水分子的结合力是相同的,错误;C、FeSO4·H2O中水的物质的量为0.03mol,其质量是5.1g,所以由图可知FeSO4·H2O存在的最高温度为373℃,正确;D、P点对应的物质的质量是4.56g,为FeSO4的质量,Q点的质量是2.4g为Fe2O3的质量,所以从P到Q发生反应的
本题难度:一般
2、选择题 标准状况下,m1g气体A与m2g气体B的分子数相等,下列说法中正确的是(??)
A.1个A分子的质量是1个B分子的质量的 倍
倍
B.同温同体积的A与B的质量比为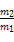
C.同温同质量的A与B的分子数比为
D.同温同压下A与B的密度比为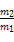
参考答案:A
本题解析:根据题意两者的分子数相等,则其物质的量相等,故可设A、B的摩尔质量分别为M1、M2,1个分子的质量分别为mA、mB则有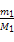 =
=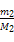 本题难度:一般
本题难度:一般
3、选择题 某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,经测定Fe3+、SO42-、Al3+和M离子的物质的量之比为2
参考答案:
本题解析:
本题难度:一般
4、选择题 设NA为阿伏伽德罗常数,下列叙述正确的是 (??? )
A.24g镁原子的最外层电子数为NA
B.1L0.1mol·L-1乙酸溶液中H+数为0.1NA
C.1mol甲烷分子所含质子数为10NA
D.标准状况下,22.4L己烯的分子数为NA
参考答案:C
本题解析:略
本题难度:简单
5、选择题 设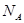 表示阿伏加德罗常数,下列叙述中正确的是
表示阿伏加德罗常数,下列叙述中正确的是
①.31g白磷含有的P—P键数为NA
②. 1mol CH3+(碳正离子)中含有电子数为10NA
③. 1mol铜与足量硫蒸气反应,转移电子数为2NA
④.1mol Mg与足量O2或N2反应生成MgO或Mg3N2,均失去2NA个电子
⑤.用惰性电极电解CuCl2溶液,阴极析出16g铜时,线路中通过的电子数为NA
⑥.0.84 g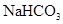 晶体中阳离子和阴离子总数为0.03NA
晶体中阳离子和阴离子总数为0.03NA
⑦.3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA
⑧.标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA
⑨.28 g C16O与28 g C18O中含有的质子数均为14×6.02×1023
⑩.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023
A ②④⑦⑧ B ③④⑥⑦⑧ C ④⑦ D④⑥⑨⑩
参考答案:C
本题解析:
试题分析:①在一个白磷P4分子中含有6个P—P共价键,所以.31g白磷含有的P—P键数为31g ÷(31×4)g/mol×NA=1.5NA.错误. ②. 1molCH3+(碳正离子)中含有电子数为9NA .错误. ③由于S的氧化性弱,在与Cu反应时1个S只能得到1个电子,所以 1mol铜与足量硫蒸气反应,转移电子数为NA。错误。④Mg是+2价的金属,因此1mol Mg与足量O2或N2反应生成MgO或Mg3N2,均失去2NA个电子。正确。⑤.用惰性电极电解CuCl2溶液,实质就是电解CuCl2本身。若阴极析出16g铜时,n(Cu)=16g÷64g/mol=0.25mol,Cu是+2价的金属,所以线路中通过的电子是0. 5mol,即电子数为0. 5NA。错误。⑥电离方程式为NaHCO3=Na++HCO3-,0.84 g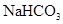 的物质的量0.01mol,所以在晶体中阳离子和阴离子总数为0.02NA.错误。⑦3.9gNa2O2的物质的量为0.05mol,每有1mol的Na2O2吸收足量的CO2时转移电子1mol,所以0.05mol的Na2O2反应转移的电子数是0.05NA。正确。⑧反应的方程式为:Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O.若有1mold Cu反应,产生NO21mol。n(Cu)=3.2g÷64g/mol=0.05mol,所以在标准状况下,3.2g铜Cu与足量的浓硝酸反应生成的气体含有的分子数是0.05NA.错误。⑨C16O相对分子质量是28,28 g C16O的物质的量为1mol,含有质子数是14×6.02×1023 ;C18O相对分子质量是30,28 g C18O中含有的质子的物质的量小于1mol,因此含有的质子数小于14×6.02×1023。错误。⑩.标准状况下,22.4 L氯气的物质的量为1mol,反应方程式为 Cl2+2NaOH=NaCl+NaClO+H2O。所以1mol的氯气与足量氢氧化钠溶液反应转移的电子数为1×6.02×1023 .错误。因此正确的说法是④⑦,选项为C。
的物质的量0.01mol,所以在晶体中阳离子和阴离子总数为0.02NA.错误。⑦3.9gNa2O2的物质的量为0.05mol,每有1mol的Na2O2吸收足量的CO2时转移电子1mol,所以0.05mol的Na2O2反应转移的电子数是0.05NA。正确。⑧反应的方程式为:Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O.若有1mold Cu反应,产生NO21mol。n(Cu)=3.2g÷64g/mol=0.05mol,所以在标准状况下,3.2g铜Cu与足量的浓硝酸反应生成的气体含有的分子数是0.05NA.错误。⑨C16O相对分子质量是28,28 g C16O的物质的量为1mol,含有质子数是14×6.02×1023 ;C18O相对分子质量是30,28 g C18O中含有的质子的物质的量小于1mol,因此含有的质子数小于14×6.02×1023。错误。⑩.标准状况下,22.4 L氯气的物质的量为1mol,反应方程式为 Cl2+2NaOH=NaCl+NaClO+H2O。所以1mol的氯气与足量氢氧化钠溶液反应转移的电子数为1×6.02×1023 .错误。因此正确的说法是④⑦,选项为C。
考点:考查阿伏加德罗常数的有关计算的知识。
本题难度:一般