微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将1.92 g铜粉与一定量浓硝酸反应,当铜粉完全反应时收集到气体1.12 L(标准状况)。则所消耗硝酸的物质的量是(???)
A.0.12 mol
B.0.11 mol
C.0.09 mol
D.0.08 mol
参考答案:B
本题解析:1.92 g铜,即0.03 mol铜,与硝酸完全反应,失去电子的物质的量为2×0.03 mol,若HNO3的还原产物仅为NO2,根据电子得失相等,n(NO2)=2×0.03 mol,
V(NO2)=2×0.03 mol×22.4 L·mol-1="1.344" L>1.12 L
说明:HNO3的还原产物不仅为NO2,还有NO,因为随着反应的进行,硝酸的浓度不断降低,必然发生如下两个反应:
Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3
本题难度:简单
2、选择题 欲观察氢气燃烧的焰色,燃气导管口的材料最好是……( )
A.钠玻璃
B.钾玻璃
C.石英玻璃
D.铜管
参考答案:C
本题解析:石英的成分是二氧化硅,在火焰下没有颜色
本题难度:简单
3、选择题 取一定量可能含有Cu(NO3)2、AgNO3、KNO3三种物质中的一种或多种成分的粉末,加热后得到A气体a L,将气体用足量的水吸收,剩余气体B的体积为a/6? L。下列相关推测正确的是
A.NO2与O2的体积比为5:1
B.气体B可能是NO2
C.NO2与O2的体积比为2:1
D.固体粉末的组成为n[Cu(NO3)2]:n(AgNO3):n(KNO3)=1:3:1
参考答案:CD
本题解析:根据所学硝酸盐加热分解相关知识可知,按金属活动性顺序有:K、Ca、Na形成的硝酸盐加热分解生成亚硝酸盐和O2;Mg至Cu形成的硝酸盐加热分解生成高价金属氧化物、NO2和O2;Hg至Au形成的硝酸盐加热分解生成金属单质、NO2和O2。
据此有:2KNO3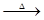 2KNO2+O2↑
2KNO2+O2↑
2Cu(NO3)2
本题难度:一般
4、填空题 (8分) 化合物A俗称石灰氮,以前是一种常用的肥料,其含氮量为35.0%,含钙量为50%。它可以用CaCO3通过下列步骤制得:

请回答下列问题:
(1)写出化学式:A________________、B________________;
(2)CaC2是__________________(填“离子”或“共价”)化合物;
(3)A与水完全反应的现象是产生白色沉淀并放出有刺激性气味的气体,写出A与水完全反应的化学方程式_______________________________________________________。
参考答案:
(1) CaCN2?(2分)??????CaO(2分
本题解析:略
本题难度:简单
5、填空题 氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。根据
题意完成下列计算:
联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮
原子的质量分数为0.977,计算确定该氢化物的分子式为??????。该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积?????L。
联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物
是氮气和水。由联氨和四氧化二氮组成的火箭推进剂恰好完全反应生成72.0 kg水,推进剂中联氨的质量为????????kg。
氨的水溶液可用于吸收NO与NO2混合气体,可消除氮氧化合物对环境的污染。请分
别写出有关的反应方程式为:?????????????????????; ??????????????????????。
参考答案:
(1)HN3或N3H (1分)??? 4.48(1分
本题解析:
试题分析:(1)N(N)=43.0×0.977÷14=3,N(H)=(43.0-14×3)÷1=1,分子式为 HN3;
n(HN3)=4.30÷43=0.1mol,根据原子守恒得到n(H2)=0.05mol,n(N2)=0.15mol
标况下体积为(0.05+0.15)×22.4=4.48L
(2)该反应方程式为2N2H4+N2O4=3N2+4H2O,根据方程式计算可得m(N2H4)=64kg
(3)4NH3+6NO=5N2+6H2O ???8NH3+6NO2=7N2+12
本题难度:一般