微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是[???? ]
A.再通入少量氯气, 减小
减小
B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量水,水的电离平衡向正反应方向移动
参考答案:D
本题解析:
本题难度:一般
2、选择题 在地壳内,深度每增加lkm,压强大约增加25250~30300kPa,在这样的压强下,对固体物质的平衡会发生较大的影响。如:
CaAl2Si2O8 + Mg2SiO4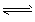 CaMg2Al2Si3O12
CaMg2Al2Si3O12
(钙长石) (镁橄榄石) (钙镁)石榴子石
摩尔质量(g/mol) 278 140.6 413.6
密度(g/cm3) 2. 70 3.22 3.50
在地壳区域变质的高压条件下,有利于 [???? ]
A.钙长石生成
B.镁橄榄石生成
C.钙长石和镁橄榄石共存
D.(钙镁)石榴子石生成
参考答案:D
本题解析:
本题难度:一般
3、选择题 已知反应A2 (g)+2B2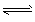 (g)2AB2 (g)为放热反应,下列说法正确的是[???? ]
(g)2AB2 (g)为放热反应,下列说法正确的是[???? ]
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增加压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
参考答案:B
本题解析:
本题难度:一般
4、填空题 合成氨对工、农业生产和国防都有重要意义。已知:25℃时,N2(g)+3H2(g)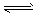 2NH3(g);△H<0,请回答:
2NH3(g);△H<0,请回答:
(1)已知:破坏1 mol N≡N键、H-H键和N-H键分别需要吸收的能量为946kJ、436kJ、391kJ。计算1mol
N2 (g) 和3 mol H2 (g) 完全转化为NH3(g)的反应热的理论值___________ 。
(2)对合成氨平衡体系改变以下条件,判断平衡移动方向:
I ①恒容容器中充入氦气,平衡________移动(填“正向”、“逆向”、“不移动”,下同);
②恒容容器中充入氮气,平衡________移动;
③恒容容器中充入氨气,平衡________移动;
II 恒压容器内充入氦气,平衡________移动。
(3)在密闭容器中,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是_________ 。
a 平衡不发生移动
b 平衡向正反应方向移动
c 平衡向逆反应方向移动
d.NH3的质量分数增加
e 正、逆反应速率都增大
(4)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是________(填序号)。
① 20 MPa -5 0 MPa
②500℃的高温
③铁触媒作催化剂
④ 将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中
参考答案:(1)-92 kJ·mol-1或92 kJ
(2)I
本题解析:
本题难度:一般
5、填空题 为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇。“绿色自由”构想的部分技术流程如下:
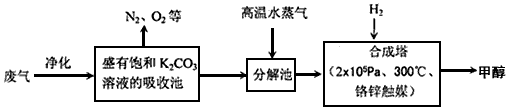
(1)合成塔中反应的化学方程式为________________;△H<0。该反应为可逆反应,从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了________________。
(2)从合成塔分离出甲醇的原理与下列_________操作的原理比较相符(填字母)
A.过滤 B.分液 C.蒸馏 D.结晶
工业流程中一定包括“循环利用”,“循环利用”是提高效益、节能环保的重要措施。“绿色自由”构想技术流程中能够“循环利用”的,除K2CO3溶液和CO2、H2外,还包括_______________ 。
(3)一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。
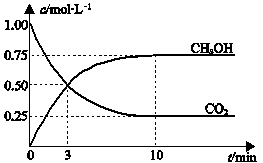
下列叙述中,正确的是_______________。
A.升高温度能使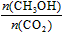 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol·L-1·min-1
(4) 如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
已知 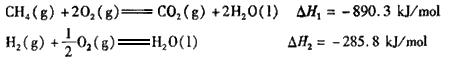
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式____________。
参考答案:(1)CO2+3H2=CH3OH+H2O ;?催化剂的催化活
本题解析:
本题难度:一般