| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《常见的化学电源》试题特训(2017年最新版)(六)
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) 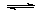 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(1)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(1)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是: 。 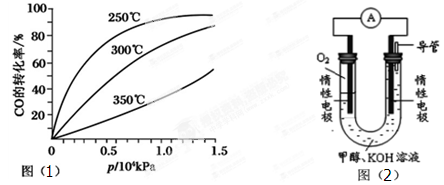 (3)依据燃烧的反应原理,合成的甲醇可以设计如图(2)所示的原电池装置。 ①该电池工作时,OH-向 极移动(填“正”或“负”)。 ②该电池正极的电极反应式为 。 参考答案:(1)-41.8;BD;1.8; 本题解析: 本题难度:困难 2、选择题 下列有关以KOH溶液为电解液的氢氧燃料电池的叙述不正确的是 |
参考答案:B
本题解析:A、原电池中负极失去电子,正极得到电子,则氧气在正极通入,电极反应式为O2 + 2H2O +4e- =4OH-,A正确;B、工作一段时间后,溶剂水增加,因此电解液中KOH的物质的量浓度减小,B错误;C、该燃料电池的总反应式为:2H2+O2=2H2O,C正确;D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)即0.1mol氯气时,根据阳极电极反应式2Cl--2e-=Cl2↑可知有0.2mol电子转移,D正确,答案选B。
考点:考查电化学原理的应用
本题难度:一般
3、选择题 关于铅蓄电池的说法正确的是? ( )。
A.在放电时,正极发生的反应是Pb(s)+SO42-(aq)-2e-=PbSO4(s)
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是PbSO4(s)+2e-=Pb(s)+SO42-(aq)
参考答案:B
本题解析:A项中电池放电时正极应发生还原反应,电极反应为:PbO2+4H++SO42-+2e-=PbSO4+2H2O;C项中电池充电时硫酸的浓度应不断增大;D项中电池充电时阳极应发生PbSO4+2H2O-2e-=PbO2+4H++SO42-。
本题难度:简单
4、填空题 燃料电池是目前正在探索的一种新型电池。它的工作原理是在燃料燃烧过程中将化学能直接转化为电能,目前已经使用的氢氧燃料电池的基本反应是:X极:O2(g) + 4e- + 2H2O(l) ="==" 4OH-
Y极:H2(g)-2e- + 2OH- ="==" 2H2O(l)
(1)X极是电池的?极(“正”或“负” ),发生?反应(“氧化”或“还原” )反应。
(2)总的电池反应方程式?
(3)若反应得到5.4g液态水,燃料电池中转移的电子为?mol
参考答案:(1)正、还原?(2)2H2 + O2 ="=" 2H2O?(3)0.6
本题解析:(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。根据方程式可知,氧气得到电子,氢气失去电子,所以X是正极,发生还原反应,Y是负极,发生氧化反应。
(2)正极和负极的电极反应式相加即得到总反应式,即2H2 + O2 ="=" 2H2O。
(3)根据总反应式可知,每生成36g水,反应中就转移4mol电子,所以若反应得到5.4g液态水,燃料电池中转移的电子为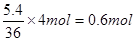 。
。
本题难度:一般
5、选择题 普通干电池中装有二氧化锰和其他物质,二氧化锰的作用是
A.和正极作用把碳变成CO2
B.把正极附近生成的氢气氧化成水
C.电池中发生化学反应的催化剂
D.和负极作用,将锌变成锌离子Zn2+
参考答案:B
本题解析:锌锰干电池负极材料是锌,正极导电材料是石墨棒。两极间为MnO2、NH4Cl、ZnCl2糊状物。负极锌发生氧化反应:
Zn(s)-2e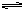 Zn2+(aq)
Zn2+(aq)
正极NH4+发生还原反应生成氨和(H),继被二氧化锰氧化为水,致使碳极附近不致形成氢气泡而使电极极化,所以二氧化锰也可称为正极的去极剂,使正极附近生成的氢气氧化为水。
正极反应:
2MnO2(s)+2NH4+(aq)+2e==Mn2O3(s)+2NH3(aq)+H2O
电池总反应为:
Zn(s)+2MnO2(s)+2NH4+(aq)==Zn2+(aq)+Mn2O3(s)+2NH3(aq)+H2O(1)
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高中化学必备知识点《物质的量》.. | ||