微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在t℃时将a g NH3完全溶于水,得到V mL溶液,假如该溶液的密度为d g/cm3,质量分数为ω,其中含NH4+的物质的量为b mol。下列叙述正确的是( )
A.溶质的质量分数为ω=×100%
B.氨水的物质的量浓度为1000a/(35V)mol·L-1
C.溶液中c(OH-)=1000b/V mol·L-1+c(H+)
D.上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5ω
参考答案:C
本题解析:A、氨水溶液溶质为氨气,该溶液的密度为ρ g?cm-3,体积为VmL,所以溶液质量为ρVg,溶质氨气的质量为ag,溶质的质量分数为ag /(ρVg) ×100%,故A错误;
B、水的密度比氨水的密度大,相等体积的氨水与水,水的质量大,等体积混合后溶液的质量大于原氨水的2倍,溶液中氨气的质量相同,等体积混合所得溶液溶质的质量分数小于0.5w,
故B错误;
C、溶液OH-中来源与一水合氨、水的电离,NH4+的浓度为bmol /(V×10-3L) ="1000b" /V? (mol/L),一水合氨电离NH3?H2O?NH4++OH-,一水合氨电离出的OH-为1000b /V? (mol/L),所以溶液中OH-浓度大于1000b /V? (mol/L),故C错误;
D、a g NH3的物质的量为ag /(17g/mol) ="a" /17 (mol),溶液体积为VmL,所以溶液的物质的量浓度为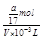 =
=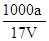 ?mol/L,故D正确.
?mol/L,故D正确.
故选:D.
点评:考查物质的量浓度、质量分数的计算与相互关系等,难度中等,理解概念是解题的关键.
本题难度:一般
2、选择题 下列溶液中的c?(Cl-)与100mL1mol?L-1?氯化铝溶液中的c?(Cl-)相等的是( )
A.300mL1mol?L-1氯化钠溶液
B.150mL2mol?L-1氯化铵溶液
C.75mL3mol?L-1氯化钾溶液
D.125mL1.5mol?L-1氯化钡溶液
参考答案:A、300mL1mol?L-1氯化钠溶液中氯离子的物质的量浓度=1mol/L×1=1mol/L;
B、150mL2mol?L-1氯化铵溶液中氯离子的物质的量浓度=2mol/L×1=2mol/L;
C、75mL3mol?L-1氯化钾溶液中氯离子的物质的量浓度=3mol/L×1=3mol/L;
D、125mL1.5mol?L-1氯化钡溶液中氯离子的物质的量浓度=1.5mol/L×2=3mol/L;
故选CD.
本题解析:
本题难度:一般
3、选择题 在V mL Al2(SO4)3溶液中含有Al3+m g,取V/4 mL该溶液用水稀释至4V mL,则SO42-物质的量浓度为
A.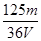 mol/L
mol/L
B.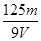 mol/L
mol/L
C.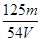 mol/L
mol/L
D.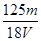 mol/L
mol/L
参考答案:A
本题解析:V mL Al2(SO4)3溶液中含有n(Al3+)= 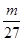 mol, n(SO42-)=
mol, n(SO42-)= 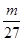 ×
×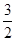 mol。V/4 mL该溶液含n(SO42-)=
mol。V/4 mL该溶液含n(SO42-)= 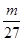 ×
×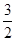 ×
×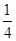 mol,故C(SO42-) = (
mol,故C(SO42-) = (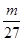 ×
×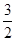 ×
×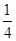 )÷(4V×10-3)=
)÷(4V×10-3)= 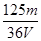 ?mol/L,故A正确。
?mol/L,故A正确。
本题难度:一般
4、选择题 用足量的CO还原23.2 g某铁的氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为40g,则此铁的氧化物的化学式是:

A.FeO
B.Fe2O3
C.Fe3O4
D.FeO2
参考答案:C
本题解析:得到的沉淀是碳酸钙,质量是40g,则物质的量是0.4mol,所以反应中生成的CO2的物质的量也是0.4mol,所以根据原子守恒可知,氧化物中氧原子的物质的量是0.4mol,质量是6.4g。则铁的质量是23.2g-6.4g=16.8g,物质的量是0.3mol,即铁原子与氧原子的物质的量是3︰4,所以氧化物的化学式是Fe3O4,答案选C。
本题难度:一般
5、选择题 关于0.2 mol/L的NaOH溶液,下列说法不正确的是( )。
A.100 mL该溶液中含0.8 g NaOH
B.200 mL该溶液与100 mL 0.2 mol/L的硫酸溶液反应形成中性溶液
C.100 mL该溶液中约含0.02 mol×6.02×1023mol-1个Na+
D.配制含1 L水的该溶液,需NaOH的质量为8 g
参考答案:D
本题解析:0.2 mol/L的NaOH溶液表示的是1L溶液中含有8g氢氧化钠,而不是1L水,D不正确,其余都是正确的,答案选D。
本题难度:一般